
医疗器械设计控制程序文件
10页1、设计开发控制程序1目的对产品设计和开发全过程进行控制,确保设计能满足合同及顾客的要求,以及政府有关的法令规定、国家标准、MDD93/42/EEC和Directive2007/47/EC欧盟指令等要求。2范围本程序适用于新产品的设计和定型产品的改进活动。3职责3.1技术部:负责编制和执行产品设计开发计划,对设计和开发全过程进行组织、协调和管理工作,组织设计评审、设计验证、设计确认工作。3.1.1负责处理生产过程中发生的产品设计问题,生产工艺的编制,工装夹具的设计与制作。3.1.2负责制定风险管理计划,提交风险管理报告。3.2生产部:负责组织试产,参与相关过程评审。3.3采购部:负责试产过程中的物料采购。3.4经营部:负责市场调研并参与相关的设计评审。3.5品质部:负责试产中产品的检验与测试。4内容4.1设计开发策划4.1.1设计项目来源4.1.1.1经营部、技术部根据国内外的市场动向,有针对性的做市场调研,收集市场情报。例如电子报刊杂志、展览会等,在需要时购回参考样机,以供技术部参考之用。4.1.1.2顾客委托设计与定型产品改良的产品,由经营部与顾客充分沟通,并收集相关资料。在情况允许的
2、条件下,由顾客提供参考样机,以供技术部参考之用。4.1.1.3经营部通过对市场调查和分析结果,提出“设计开发建议书”,报总经理批准后,连同有关资料转交技术部。4.2设计开发输入4.2.1技术部根据新产品“设计开发建议书”或参考样机,编制“设计任务书”,“设计任务书”应规定对设计的要求,内容包括:A根据预期用途和使用说明,规定产品的功能、性能、结构和软件的要求。BISO13485:2003标准、MDD93/42/EEC和Directive2007/47/EC欧盟指令、ISO14971:2000等相关的法律和法规的要求,以及使用者和患者的要求。C过去类似设计的有关信息。D设计和开发必需的其他要求,如安全、包装、运输、贮存、环境、经济性方面的要求等。E风险管理计划(风险活动执行“风险管理控制程序”)。F医疗器械的寿命要求。G供方的选择,对于产品的关键元器件,必要时,供方应共同参与风险的评估。4.2.2“设计任务书”经技术部门审核后,报总经理批准。4.2.3技术部根据批准的“设计任务书”,制定“设计开发计划书”,内容应包括:A设计和开发的各个阶段。B适合各阶段的设计评审、验证、确认活动。C每个
3、阶段的任务、责任人、进度要求。D需要增加和调整的资源。E其他必要的内容,如在本程序文件中没有确定的职责和权限以及接口管理的要求,都应在计划中确定下来。4.2.4“设计开发计划书”经技术部门负责人审核后,报总经理批准,在实施的过程中,需要对设计和开发的进展进行修改时,应重新报总经理批准后,方可实施。4.2.5技术部做好设计各阶段的组织和协调工作,做好参与设计相关部门、人员间的信息沟通,必要时以会议形式沟通。4.2.6设计输入评审4.2.6.1设计输入完成后,技术部应组织相关部门及人员对设计输入进行评审,评审的主要内容:A “设计任务书”所规定的内容完整性,合理性。B产品预期用途、功能、结构等。C满足顾客要求的程度,以及政府有关法令、规定、国家标准、国际惯例的符合性。如“MDD93/42/EEC指令”,“国家医疗器械管理规定”等。D“设计开发计划书”所包括的内容。E资源的调整。4.2.6.2技术部根据评审情况编写“设计输入评审报告”,应包括需要采取的措施,经技术部负责人审核后,报总经理批准,技术人员对需要采取的措施进行跟踪。4.3设计开发输出4.3.1初步技术设计4.3.1.1技术部人员按
4、“设计任务书”和“设计输入评审报告”的要求进行初步技术设计,完成产品的全部图样及设计文件,包括外形图、电路图、PCB板图、丝印图、BOM、装箱单、彩盒图、使用说明书、产品标准样等。4.3.1.2对产品的安全和正常使用所必要的产品特性,应标识在相关的图样及设计文件中,或在图样及设计文件中做特别的说明。4.3.1.3按“风险管理控制程序”输出产品“风险管理报告”,风险管理报告的编写应以医疗器械风险管理对医疗器械的应用、ISO14971:2000、MDD93/42/EEC和Directive2007/47/EC欧盟指令的相关要求等为参考依据。4.3.2样机试制及验证4.3.2.1技术部根据产品图样及设计文件制作样机,并对样机的外观结构、性能及参数,将结果记录在“电性参数记录表”中。4.3.2.2试制合格的样机,必要时由经营部送顾客验证,经营部将顾客验证情况及时反馈给技术部门。4.3.2.3技术部根据样机试制、测试中所提出的改进意见对产品图样及设计文件进行修改。4.3.2.4技术部根据样机试制、测试情况和顾客的验证结果编写“设计验证报告”,内容应包括每一项技术参数或性能指标,以及样机试制、检测
《医疗器械设计控制程序文件》由会员jiups****uk12分享,可在线阅读,更多相关《医疗器械设计控制程序文件》请在金锄头文库上搜索。

建立安全生产长效机制-共创和谐平安输气管道

土石方爆破工程设计方案

康师傅百货商场制度汇编之退换货管理办法

庙头中学2012年中考百日誓师大会学生代表发言稿

围堰拆除爆破工程

华能洱源马鞍山风电场工程土石方爆破管理制度

国资委:全面开展管理提升活动-为培育世界一流企业奠定坚实基础

《专业技术人员职业发展与规划》电子书

应收票据审计方案
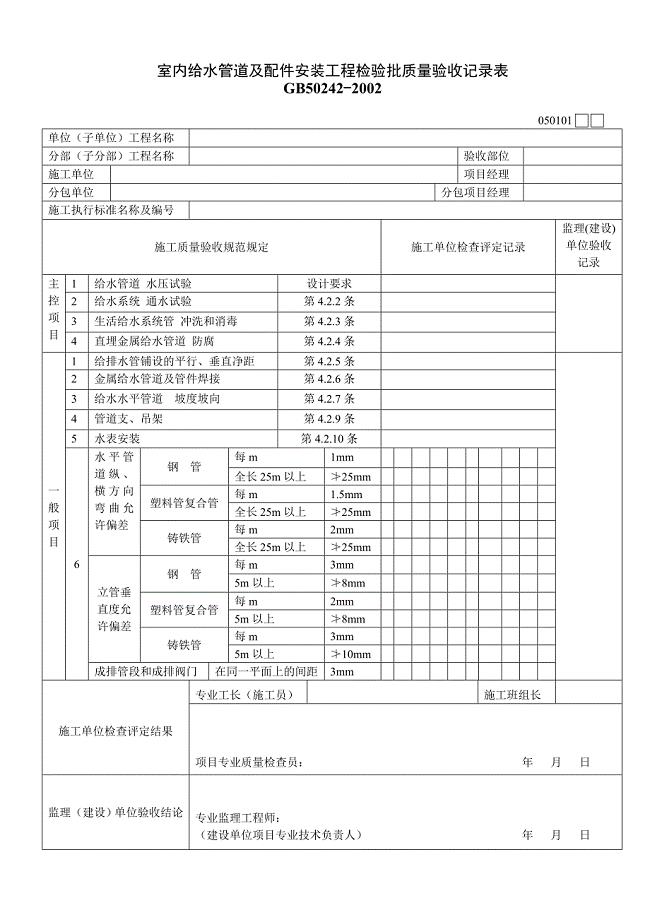
建筑给水排水与采暖工程质量验收用表

广播电视管理条例行政处罚裁量标准

广东电力系统调度运行操作管理规定

建筑给排水工程名词解释

幼儿园小班安全健康活动教案:宝宝误食后的急救

建业集团房屋建筑工程交房标准内容技术交底

建筑心理学论文(1)

康师傅百货商场制度汇编之工服管理程序009

建筑工程专业一级建造师继续教育培训结业报告20

廉洁风险防控回头看工作汇报材料

平台工作人员服务规范
 小数数学题:简便计算11道练习题及参考答案A10
小数数学题:简便计算11道练习题及参考答案A10
2024-04-17 2页
 小数数学题:简便计算11道练习题及参考答案A7
小数数学题:简便计算11道练习题及参考答案A7
2024-04-17 2页
 小数数学题:简便计算11道练习题及参考答案A3
小数数学题:简便计算11道练习题及参考答案A3
2024-04-17 2页
 小数数学题:简便计算11道练习题及参考答案A5
小数数学题:简便计算11道练习题及参考答案A5
2024-04-17 2页
 小数数学题:简便计算11道练习题及参考答案A9
小数数学题:简便计算11道练习题及参考答案A9
2024-04-17 2页
 小数数学题:简便计算11道练习题及参考答案A6
小数数学题:简便计算11道练习题及参考答案A6
2024-04-17 2页
 小数数学题:简便计算11道练习题及参考答案A8
小数数学题:简便计算11道练习题及参考答案A8
2024-04-17 2页
 小数数学题:简便计算11道练习题及参考答案A1
小数数学题:简便计算11道练习题及参考答案A1
2024-04-17 2页
 小数数学题:简便计算11道练习题及参考答案A4
小数数学题:简便计算11道练习题及参考答案A4
2024-04-17 2页
 小数数学题:简便计算11道练习题及参考答案A2
小数数学题:简便计算11道练习题及参考答案A2
2024-04-17 2页

