
北师大考研无机化学复习题第五章
9页1、第 5 章 酸 碱 和 酸 碱 反 应一、 基本要求 1理解布朗斯特酸碱、路易斯酸碱和软硬酸碱理论的意义和要点;2掌握一元弱酸、弱碱的pH的计算公式;3掌握缓冲溶液pH的计算;4盐的水解及其溶液pH的计算。二、 要点1 酸 酸是(1)含氢的化合物,在适当的条件下产生氢离子(阿累尼乌斯理论);(2)质子受体(布朗斯特-劳瑞理论);(3)能够接受电子对的原子、离子或分子,形成共价键(路易斯理论)。2 碱 碱是(1)在水溶液中能够产生氢氧根离子的化合物(阿累尼乌斯理论);(2)质子接受体(布朗斯特-劳瑞理论);(3)能够给出电子对的原子、离子或分子,形成共价键(路易斯理论)。3 中和 中和反应是指酸和碱作用生成水和盐的反应。4 共轭酸 布朗斯特-劳瑞碱得质子产生共轭酸,相对每一个碱都有其共轭酸。5 共轭碱 布朗斯特-劳瑞酸失质子产生共轭碱,相对每一个酸都有其共轭碱。6 强、弱酸 水溶液中可完全离解成离子的酸是强酸,而部分解离的酸是弱酸。7 强、弱碱 水溶液中可完全离解成离子的碱是强碱,而部分解离的碱是弱碱。8 酸性常数, 是指弱酸质子转移反应的平衡常数。又叫酸的解离常数。9 碱性常数, 是指
2、弱碱质子转移反应的平衡常数,又叫碱的解离常数。10 两性现象 是指一些氧化物和羟基化合物既可作酸也可作碱。11 水合氢离子 水溶液中质子的存在形式。12 水的质子自递常数 在纯水或水溶液中,氢离子浓度与氢氧根离子浓度的乘积称作水的质子自递常数,它仅随温度的变化而变化,25 时,= 1.0 10-14,又称作“水的离子积”。13 自身解离 自身解离是一类酸碱反应,其中一个分子作为酸提供质子给另一个作为碱的分子而完成中和反应。 14 区分效应 基于酸碱质子理论,较溶剂水而言,以难于接受质子的溶剂可分辨出物质酸性强弱。对于要区分的物种,该溶剂称作分辨试剂,其作用具有区分效应。15 含氧酸的分类 在水溶液中能给出羟基质子的布朗斯特酸,均含有氧原子,因而叫含氧酸,其按组成可分为三类:1. 水合酸 水合酸的酸质子处在与金属离子配位的水分子中;2. 羟合酸 羟合酸的酸质子处在相邻位置上没有氧基的羟基上;3. 氧合酸 氧合酸的酸质子也处在羟基上,但与羟基相连的中心原子上带有若干个氧基。16 鲍林规则 鲍林提出的可用来粗略估算氧合酸OpE(OH)q (p和q分别代表氧基和羟基的数目)的两条规则:1. 电
3、中性氧合酸的 8 5p。2. 多元酸 (q 1) 多步质子转移反应的值逐级增加5。17 软硬酸碱 硬酸 路易斯酸,具有体积小、正电荷多、不易变形和失去电子、易形成离子性较强的键的物质;软酸 路易斯酸,具有体积大、正电荷少、易变形、易失去电子、易形成共价性较强的键的物质;硬碱 路易斯碱,具有电负性大,不易变形、不易失去电子、而且其低能轨道已饱和、易形成离子性较强的键的物质;软碱 路易斯碱,具有电负性小、易变形、易失去电子,其低能轨道不饱和,易形成共价性较强的键的物质。18 盐的水解 盐在水溶液中使水的电离平衡发生移动从而可能改变溶液的酸度,这种作用称作盐的水解。当水解达到平衡时,溶液中各离子浓度的乘积项为一常数,称作水解平衡常数。19 缓冲溶液 由弱酸与其共轭碱或者弱碱与其共轭酸组成的酸碱系统,它能阻止外加的少量酸、碱(或反应过程中产生的少量酸、碱,或一定范围内稀释作用)使系统的pH产生剧烈变化。20 电离度 弱酸及弱碱在溶液中电离出的百分数称作其电离度。物质的起始浓度越小,电离度越大。21 电离平衡 也称离子平衡, 化学平衡的一种。指在水溶液弱电解质分子和离子之间的动态平衡,例如醋酸的
《北师大考研无机化学复习题第五章》由会员jiups****uk12分享,可在线阅读,更多相关《北师大考研无机化学复习题第五章》请在金锄头文库上搜索。

建立安全生产长效机制-共创和谐平安输气管道

土石方爆破工程设计方案

康师傅百货商场制度汇编之退换货管理办法

庙头中学2012年中考百日誓师大会学生代表发言稿

围堰拆除爆破工程

华能洱源马鞍山风电场工程土石方爆破管理制度

国资委:全面开展管理提升活动-为培育世界一流企业奠定坚实基础

《专业技术人员职业发展与规划》电子书

应收票据审计方案
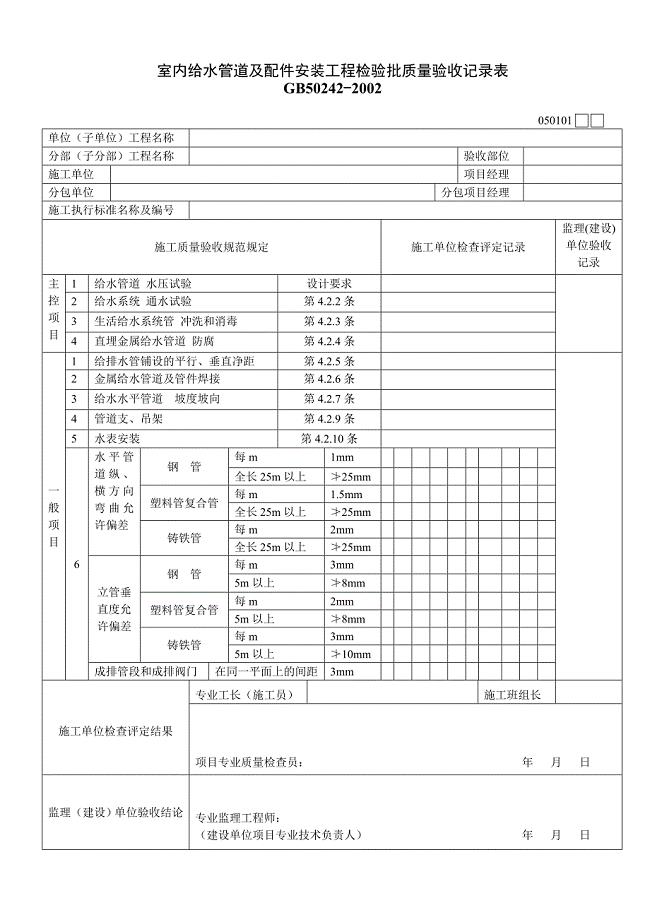
建筑给水排水与采暖工程质量验收用表

广播电视管理条例行政处罚裁量标准

广东电力系统调度运行操作管理规定

建筑给排水工程名词解释

幼儿园小班安全健康活动教案:宝宝误食后的急救

建业集团房屋建筑工程交房标准内容技术交底

建筑心理学论文(1)

康师傅百货商场制度汇编之工服管理程序009

建筑工程专业一级建造师继续教育培训结业报告20

廉洁风险防控回头看工作汇报材料

平台工作人员服务规范
 辽宁省本溪市2022-2023学年高中下学期学业水平考试美术试题【含答案】
辽宁省本溪市2022-2023学年高中下学期学业水平考试美术试题【含答案】
2024-04-23 4页
 第六单元 正比例和反比例 (单元测试卷)苏教版数学六年级下册【含答案】
第六单元 正比例和反比例 (单元测试卷)苏教版数学六年级下册【含答案】
2024-04-23 10页
 江苏省无锡市2024年七年级下学期期中数学调研试卷【含答案】
江苏省无锡市2024年七年级下学期期中数学调研试卷【含答案】
2024-04-23 19页
 江苏省江阴市华士片2022-2023学年七年级下学期期中语文试题【含答案】
江苏省江阴市华士片2022-2023学年七年级下学期期中语文试题【含答案】
2024-04-23 10页
 江苏省泰州兴化市2023-2024学年高一下学期期中考试语文试题【含答案】
江苏省泰州兴化市2023-2024学年高一下学期期中考试语文试题【含答案】
2024-04-23 16页
 小学六年级体育与健康测试题【含答案】
小学六年级体育与健康测试题【含答案】
2024-04-23 5页
 2023年北京市西城区八年级(下)期末语文试卷【含答案】
2023年北京市西城区八年级(下)期末语文试卷【含答案】
2024-04-23 16页
 江苏省南京市2024年中考数学模拟题【含答案】
江苏省南京市2024年中考数学模拟题【含答案】
2024-04-23 18页
 上海市奉贤区2024届高三二模语文试题【含答案】
上海市奉贤区2024届高三二模语文试题【含答案】
2024-04-23 8页
 统编版小学语文六年级下册第四单元知识小结
统编版小学语文六年级下册第四单元知识小结
2024-04-23 11页

