
晶体晶胞结构
17页1、物质结构要点1、 核外电子排布式 外围核外电子排布式 价电子排布式 价电子定义:1、对于主族元素,最外层电子 2、第四周期,包括3d与4S 电子 电子排布图熟练记忆 Sc Fe Cr Cu2、 S能级只有一个原子轨道 向空间伸展方向只有1种 球形P能级有三个原子轨道 向空间伸展方向有3种 纺锤形d能级有五个原子轨道 向空间伸展方向有5种 一个电子在空间就有一种运动状态例1:N 电子云在空间的伸展方向有4种 N原子有5个原子轨道 电子在空间的运动状态有7种 未成对电子有3个 -结合核外电子排布式分析例2、基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4。3、 区的划分按构造原理最后填入电子的能级符号如Cu最后填入3d与4s 故为ds区 Ti 最后填入能级为3d 故为d区4、 第一电离能:同周期从左到右电离能逐渐增大趋势(反常情况:S2 与P3 半满或全满较稳定,比后面一个元素电离能较大)例3、比较C、N、O、F第一电离能的大小 - F NOC例4、某元素的全部电离能(电子伏特)如下:I1I2I3I4I5I6I7I823.635.154.977.4113.
2、9138.1739.1871.1回答下列各问:(1)I6到I7间,为什么有一个很大的差值?这能说明什么问题? _(2)I4和I5间,电离能为什么有一个较大的差值_(3)此元素原子的电子层有 _层。最外层电子构型为 _5、 电负性:同周期从左到右电负性逐渐增大(无反常)-F O N C6、 对角线规则:某些主族元素与右下方的主族元素的性质有些相似,被称为“对角线规则”如:锂和镁在空气中燃烧的产物,铍和铝的氢氧化物的酸碱性以及硼和硅的含氧酸酸性的强弱7、共价键:按原子轨道重叠形式分为:键 和键 (具有方向性和饱和性)单键 - 1个 键 双键-1个 键 和1个键 三键-1个 键 和2个键 8、等电子体:原子总数相等,价电子总数相等-具有相似的化学键特征例5、N2 CO CN- C22- 互为等电子体 CO2 CS2 N2O SCN- CNO- N3- 互为等电子体从元素上下左右去找等电子体,左右找时及时加减电荷,保证价电子相等。9、应用VSEPR理论判断下表中分子或离子的构型。化学式键电子对数中心原子含有孤对电子对数VSEPR模型分子立体构型杂化类型ABnSO3对于给出结构的分子或离子,根据
3、中心原子成四个价键(8个电子),直接判断.(B原子六个电子)例6、N原子的杂化类型 PO42- P的杂化类型 _ CH3CHO C原子的杂化类型_Ni(CO)4 中心原子的杂化_10、配合物配位键也是共价键,属于键 。例7、中心原子或离子配体配位原子或离子配位数Fe(CO)5Fe(SCN)3Zn(CN) 4-Al F6-规律:一般是电负性较大的原子吸引电子能力较强,电子对不易给出,不作为配位原子11、分子间作用力:一般分子间作用力范德华力 氢键例8、Na2B4O7.10H2O晶体中存在的作用力_ 12、氢键存在:一个分子的X-H中的H原子与另外的X原子相结合而成(X表示N、O、F)表示方法:AHB例9、写出氨水中氢键的种类NHN NHO OHO OHN 共4种H2O分子中氢键的数目 -1个水分子形成4个氢键-1mol H2O分子含氢键2NA HF分子中氢键的数目-1个HF分子形成2个氢键-1molHF分子含氢键NA氢键对某些现象的解释i解释分子熔沸点的大小II解释物质溶解性的大小III解释冰融化为水密度减小,体积增大:氢键的存在使处于中心的水分子与其他水分子呈四面体,空间利用率较低,溶
《晶体晶胞结构》由会员suns****4568分享,可在线阅读,更多相关《晶体晶胞结构》请在金锄头文库上搜索。

土地管理与地籍测量---第八章界址点测量
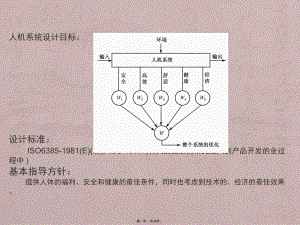
人机工程学案例分析(2)

工程安全培训_201303

第9章房地产投资决策分析

第2章房地产经纪制度

ACM程序设计-东北林业大学acm05

《亲爱的汉修先生》读书交流会

中原_深圳新世界尖岗山项目市场汇报_40P_2012年_别墅_项目分析_量价走势

五年级数学质量分析演示文稿

人工智能小镇-智慧小镇建设20180525

景观基本知识及发展历程

建设工程信息管理(2)

机电驱动技术第二章步进驱动技术
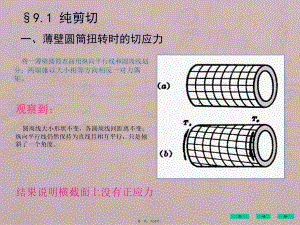
工程力学-第9章圆轴扭转时的应力变形分析与强度刚度设计

第一章第二节幼儿园文化环境建设的原则

第一章检测技术的基础知识

第一章__现代表面工程技术

第六章钢结构工程

第9节项目试运行管理

班主任工作经验交流课件(4)
 北京语言大学21春《社会语言学》在线作业二满分答案25
北京语言大学21春《社会语言学》在线作业二满分答案25
2022-08-15 14页
 东北大学21秋《机床数控技术》在线作业二答案参考29
东北大学21秋《机床数控技术》在线作业二答案参考29
2023-06-30 13页
 GB11120-2011《涡轮机油》国家标准
GB11120-2011《涡轮机油》国家标准
2023-03-25 4页
 东财21秋《社会保险X》在线作业二答案参考30
东财21秋《社会保险X》在线作业二答案参考30
2023-07-24 14页
 大连理工大学21秋《管理学》基础在线作业二答案参考88
大连理工大学21秋《管理学》基础在线作业二答案参考88
2024-02-02 12页
 东北农业大学21秋《电力企业管理》平时作业一参考答案4
东北农业大学21秋《电力企业管理》平时作业一参考答案4
2022-11-21 14页
 第二章分离变量法22,23
第二章分离变量法22,23
2022-11-21 8页
 Tris-HCl及其他几种缓冲液配方
Tris-HCl及其他几种缓冲液配方
2022-12-21 3页
 聚合物分子设计大作业
聚合物分子设计大作业
2023-04-02 8页
 南开大学22春《数据科学导论》离线作业一及答案参考94
南开大学22春《数据科学导论》离线作业一及答案参考94
2022-08-05 13页

