
酶工程:酶分子修饰
49页1、酶分子修饰,酶 工 程,通过各种方法使酶分子的结构发生某些改变,从而改变酶的催化特性的技术过程。 属于酶分子工程的一部分。,什么是酶分子修饰?,酶分子修饰的意义,提高酶的活力 增强酶的稳定性 降低或消除酶的抗原性 研究和了解酶分子中主链、侧链、组成单位、金属离子和各种物理因素对酶分子空间构象的影响,第一节 金属离子置换修饰,把酶分子中所含的金属离子换成另一种金属离子,使酶的催化特性发生改变的修饰方法。 常用的金属离子 Ca2+,Mg2+,Mn2+,Zn2+,Co2+,Cu2+,Fe2+ 适用性 本来在结构中含有金属离子的酶。,一、金属离子置换修饰的方法,(1)加入一定量的EDTA(乙二胺四乙酸)等金 属螯合物到酶液中,与酶分子中的金属离子螯合; (2)通过透析、超滤、分子筛层析等方法,从酶液中去除 EDTA-金属螯合物; (3)加入另一种金属离子到酶液中,酶蛋白与新加入的金属离子结合。,二、金属离子置换修饰的作用,、阐明金属离子对酶催化作用的影响 、提高酶活力 锌型蛋白酶置换成钙型蛋白酶,酶活力可提高20-30倍;制成晶体,比锌型蛋白酶结晶的酶活力提高2-3倍。 、增强酶稳定性 天然含
2、铁超氧化物歧化酶中铁原子被锰取代后,酶的稳定性和抑制作用发生显著改变,重组的含锰酶对H2O2的稳定性显著增强,对NaH3的抑制作用的敏感性显著降低。 、改变酶动力学特性 酰化氨基酸水解酶活性部位中的锌被钴取代时,酶的底物专一性和最适pH都有改变,锌酶对N-氯-乙酰丙氨酸的最适pH是8.5,而钴酶的最适pH是7.0,并且对N-氯-乙酰丙氨酸等三种底物的活力降低,m增大,亲和力降低。,第二节 大分子结合修饰,利用水溶性大分子与酶的侧链基团共价结合,使酶分子的空间构象发生改变,从而改变酶的催化特性的方法。,水溶性大分子:右旋糖酐、聚乙二醇(PEG)、肝素、蔗糖聚合物等,、修饰剂的选择,一、大分子结合修饰的方法,大分子在使用前一般需经过活化,活化基团 才能在一定条件下与酶分子某侧链基团反应。,、修饰剂的活化,通过修饰提高酶活力,酶催化剂能力本质上是由其特定的空间结构特别是其活性中心的特定构象所决定 水溶性大分子通过共价键与酶分子结合后可使酶的空间结构发生某些改变,使酶的活性中心更有利于和底物结合并形成准确的催化部位,使酶活力提高。 1分子核糖核酸酶与6.5分子右旋糖酐结合,活力提高2.25倍。
3、,二、大分子结合修饰的作用,增加酶稳定性,酶的稳定性较低是普遍存在的。采用大分子与酶结合,形成复合物,就可起到保护酶的天然构象的作用,从而增加酶的稳定性。,表5-1 天然SOD与修饰后SOD在人血浆中的半衰期,降低或消除抗原性,抗原能引起体内产生抗体的物质。 抗体当外源蛋白非经口进入人或动物体内后,体内血清中就可能出现与此外源蛋白特异结合的物质称之为抗体。 当酶非经口(如注射)进入人体后,往往会成为一种抗原,刺激体内产生抗体。当这种酶再次注射进体内时,抗体就会与作为抗原的酶特异地结合,使酶失去催化功能。用PEG修饰色氨酸酶可完全消除该酶的抗原性。,第三节 酶蛋白侧链基团修饰,采用一定的方法使酶蛋白的侧链基团发生改变,从而改变酶的催化特性的修饰方法。 用于研究酶分子结构与功能: ()荧光试剂修饰,了解酶水溶液中构象; ()各基团对酶的影响,必需基团; ()某基团数量; ()改变酶性能,其侧链功能基团有氨基、羧基、巯基、咪唑基、吲哚基、酚羟基、羟基、胍基、甲硫基等,这些基团可组成各种副键对蛋白质空间结构的形成和稳定起重要作用。这些功能基团发生改变,引起副键改变,使空间结构发生某些变化,从而
4、引起酶特性和功能的改变。,蛋白酶类的修饰,(1)氨基修饰 (2)羧基修饰 ()巯基修饰 ()胍基修饰 (5)酚基修饰 ()咪唑基修饰 ()吲哚基修饰 ()分子内交联修饰,侧链基团修饰方法,三硝基苯磺酸(TNBS)是非常有效的氨基修饰剂。,反应式,氨基的化学修饰,多肽链N-末端残基的化学修饰: 2,4-二硝基氟苯(DNFB)法、 丹磺酰氯(DNS)法、 苯异硫氰酸酯(PITC)法。,碳二亚胺修饰酶的羧基已成为最普遍的方法,条件温和。,反应式,羧基的化学修饰,+,巯基的化学修饰,巯基在维持亚基间相互作用和酶催化过程中起重要作用,具很强的亲核性,在含半胱氨酸的酶分子中是最易反应的侧链基团。,1、烷基化试剂(如碘乙酸等); 2、N-乙基马来酰亚胺。,巯基修饰剂,具两个邻位羰基的化合物,如丁二酮等,是修饰精氨酸残基的重要试剂; 精氨酸残基在结合带有阴离子底物的酶活性中心部位起重要作用。,精氨酸胍基的化学修饰,反应式,酚基的化学修饰,1、碘化法 2、硝化法 3、琥珀酰化法,酪氨酸残基上含有酚基,酚基经修饰后,引入负电荷,增加了对正电荷底物的结合力。,修饰方法:,分子内交联剂,含两个反应活性部位的双
《酶工程:酶分子修饰》由会员hu****a8分享,可在线阅读,更多相关《酶工程:酶分子修饰》请在金锄头文库上搜索。

《小学生防溺水安全教育班会》教案

《中小学预防传染病知识主题班会》教案

《幼儿园防溺水安全教育班会》教案模板

小学开学第一课主题班会教案八篇

垃圾分类主题班会《保护环境 美化校园》教案

小学开学第一课主题班会教案和含演讲稿
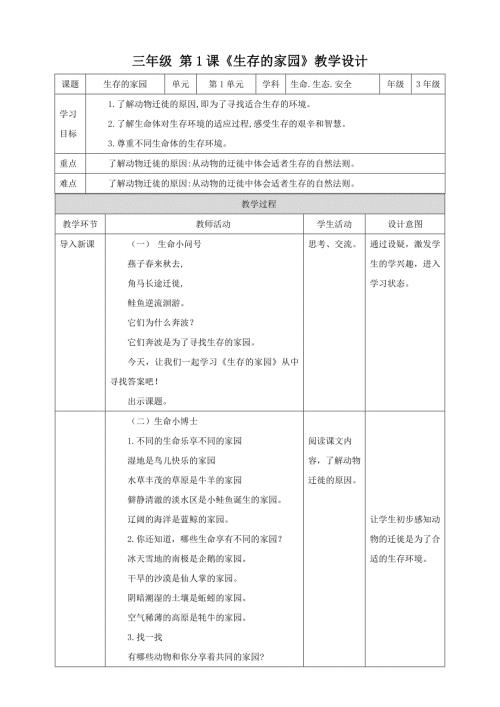
第1课《生存的家园》教学设计
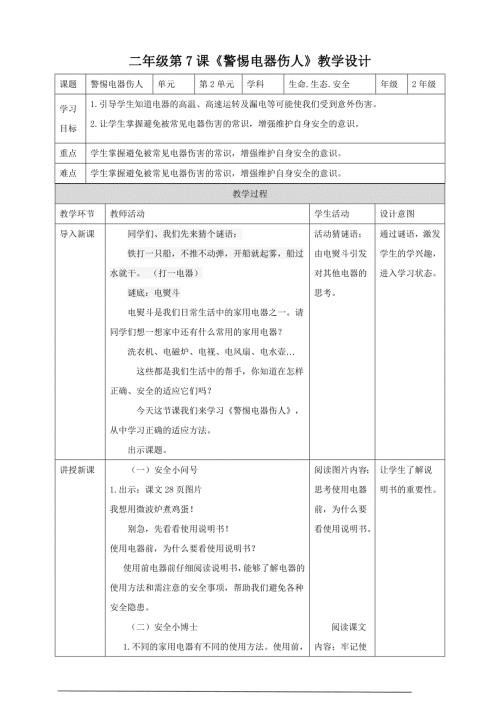
第7课《警惕电器伤人》教学设计
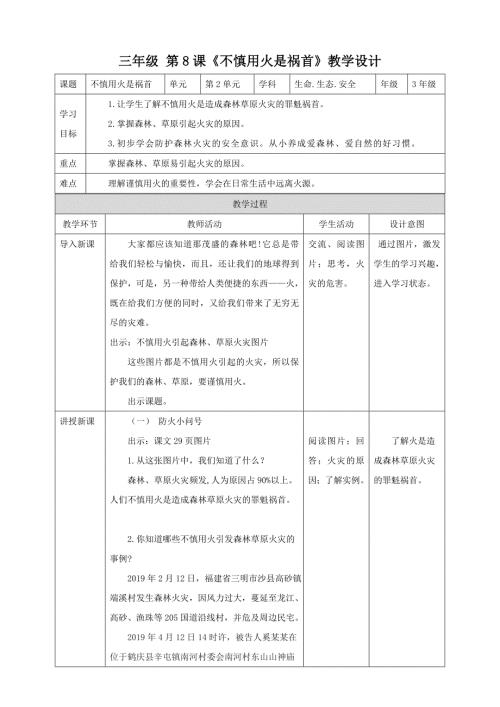
第8课《不慎用火是祸首》教学设计
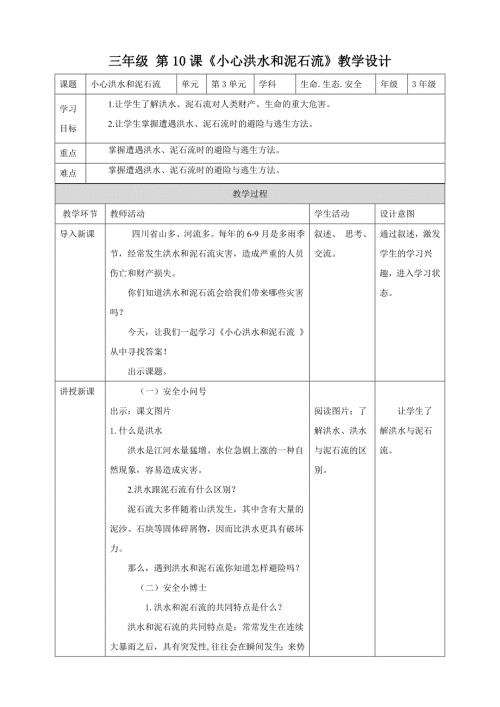
第10课《小心洪水和泥石流》教学设计
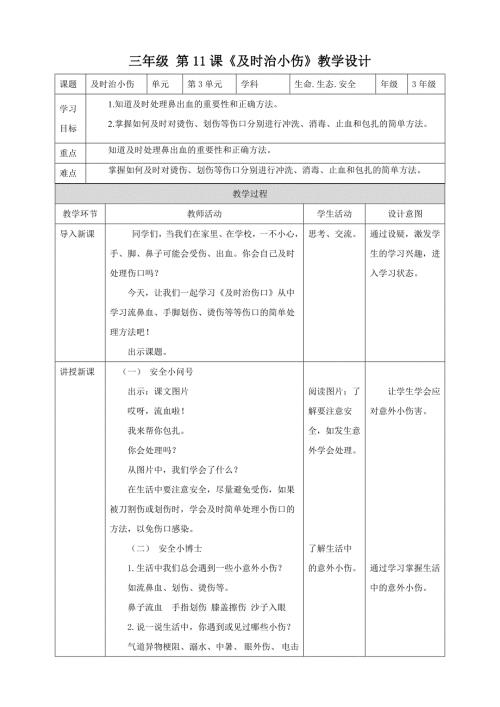
第11课《及时治小伤》教学设计
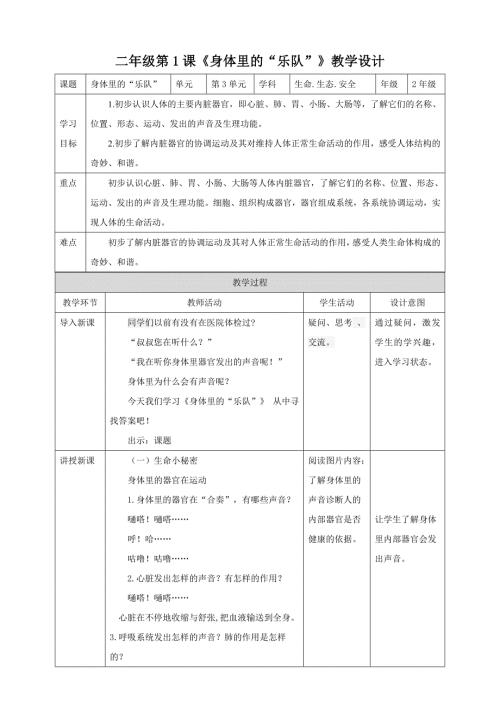
第1课《身体里的“乐队”》教案
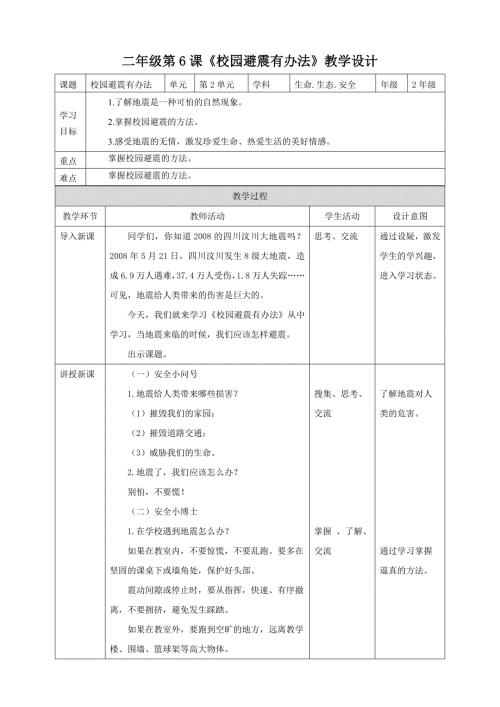
第6课《校园避震有办法》教学设计
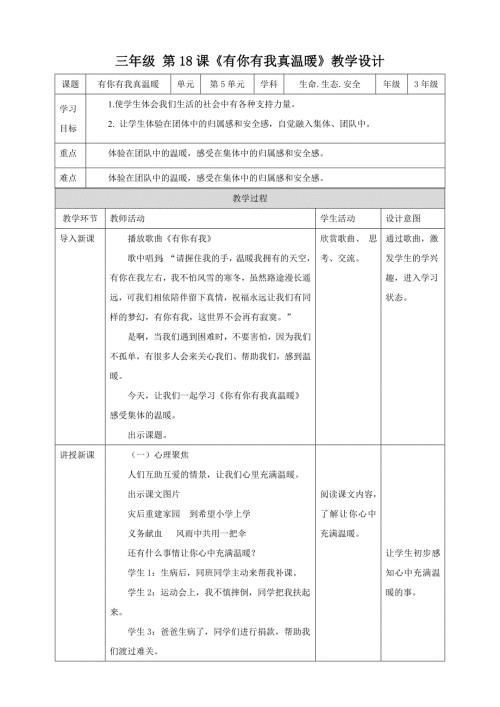
第18课《有你有我真温暖》教学设计
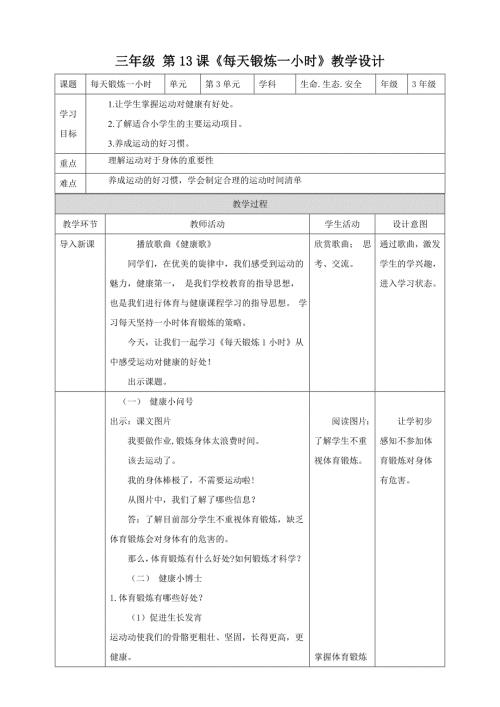
第13课《每天锻炼一小时》教学设计
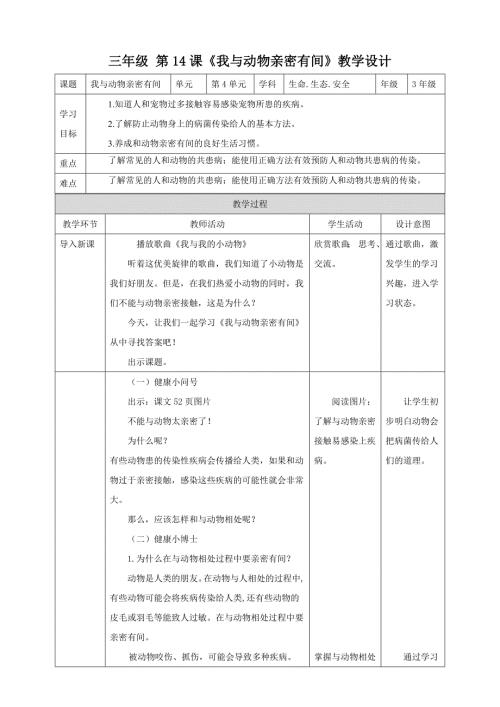
第14课《我与动物亲密有间》教学设计
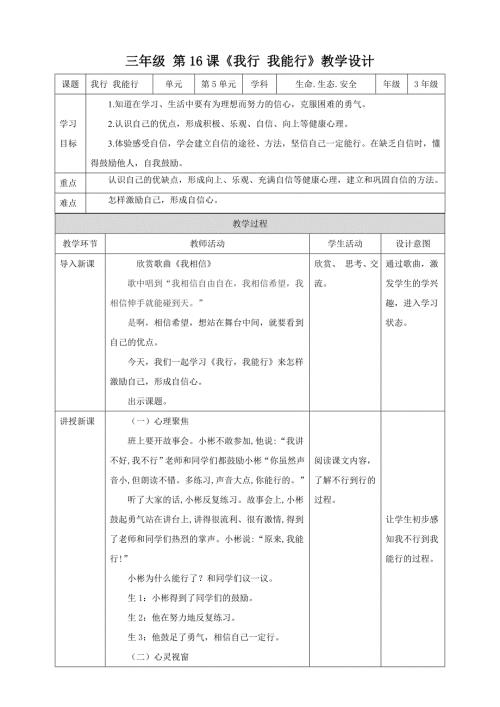
第16课《我行我能行》教学设计
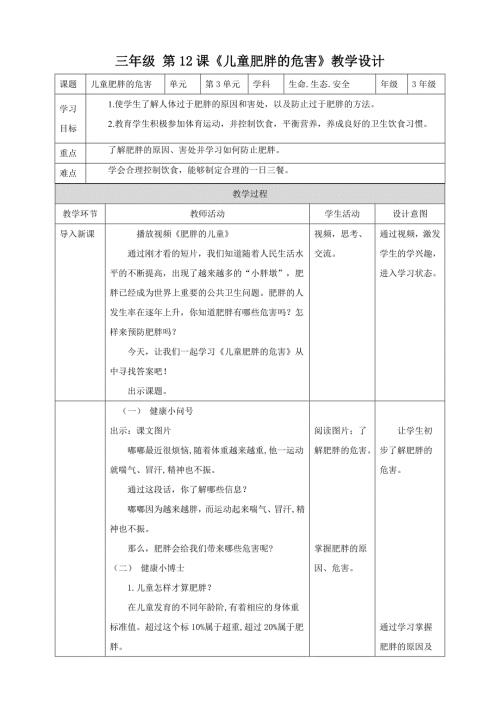
第12课《儿童肥胖的危害》教学设计

第17课《美丽的插花》教学设计

第8课《我和规则做朋友》教学设计
 突发新冠疫情封闭式管理应急预案培训
突发新冠疫情封闭式管理应急预案培训
2024-04-08 16页
 医生护士培训课件:心力衰竭病理诊断治疗
医生护士培训课件:心力衰竭病理诊断治疗
2024-04-08 55页
 医疗培训课件:护理护士岗位职责
医疗培训课件:护理护士岗位职责
2024-04-06 35页
 医院护士护理培训课件:疼痛管理
医院护士护理培训课件:疼痛管理
2024-04-06 38页
 医院医疗保护性约束的基础护理培训课件
医院医疗保护性约束的基础护理培训课件
2024-04-06 25页
 医疗垃圾的分类及处理垃圾分类专题培训
医疗垃圾的分类及处理垃圾分类专题培训
2024-04-06 22页
 医院医疗导师带徒工作汇报课件
医院医疗导师带徒工作汇报课件
2024-04-06 17页
 医疗培训课件:护士岗位职责
医疗培训课件:护士岗位职责
2024-03-21 31页
 医疗医院年终工作总结课件
医疗医院年终工作总结课件
2024-03-21 33页
 护理应知应会培训课件
护理应知应会培训课件
2024-02-20 68页

