
无机化学:电解质溶液
40页1、无机化学,电解质溶液,第一节 强电解质溶液理论 第二节 酸碱理论 第三节 水溶液中的质子转移平衡及有关计算,电解质溶液,第一节 强电解质溶液理论,根据定义,强电解质在水中完全解离, =100%,几种强电解质的表观解离度(0.10molL-1, 298K),电解质 KCl HCl HNO3 H2SO4 NaOH Ba(OH)2 ZnSO4,(%) 86 92 92 61 91 81 40,100%,一、离子相互作用理论,1.强电解质在水中完全解离;,2.由于阴阳离子之间的相互作用,形成“离子氛”;,3. 离子氛的存在使得离子运动不完全自由。, 解离度 100% 称为表观解离度,二、离子的活度和活度系数,1. 活度():有效浓度,2. 活度系数 一般 1, = c,c 实际浓度 活度系数,活度系数 的 大小主要取决于离子间的相互作用,(1)稀溶液中的离子浓度很小,活度接近浓度,即 1。 (2)溶液中的中性分子也有活度和浓度的区别,通常把中性分子的活度因子视为1。 (3)对于弱电解质溶液,因其离子浓度很小,一般可以把弱电解质的活度因子也视为1。,三、离子强度与离子活度系数的关系,1离子强度I
2、,c 某种离子的浓度 z 某种离子的电荷,例 计算把0.10molL-1K3Fe(CN)6溶液和0.10molL-1K2SO4溶液等体积混合后的溶液的离子强度 。,解:等体积混合后,各物质浓度均减半:,= 0.45,C( K3Fe(CN)6)= C( K2SO4)= 0.050molL-1,C( K +)= 0.0505=0.25molL-1,C( Fe(CN)6 3-)= 0.050molL-1,C( SO42-)= 0.050molL-1,离子强度表征离子间相互作用的强弱,2.德拜休克尔极限稀释公式,活度系数 与离子强度I成反向关系,离子强度I取决于离子的浓度与电荷,第二节 酸碱理论,一、酸碱电离理论(阿累尼乌斯酸碱理论),凡是在水中能解离出H+的物质是酸(acid), 能解离出OH-的物质是碱(base)。,酸碱反应的实质是:H+OH-=H2O。,局限性:,二、酸碱质子理论,(一) 酸碱定义,凡能给出质子(H+)的物质称为酸 凡能接受质子(H+)的物质称为碱,如:,酸,明显进步:,脱离了水的限制,酸碱的相互联系,着眼于反应,碱,HAc H+ + Ac-,酸碱共轭关系,共轭酸碱对:
3、,一种酸释放一个质子后形成其共轭碱, 一种碱结合一个质子后而形成其共轭酸 。,共轭酸比它的共轭碱多一个质子。,质子理论没有盐的概念,如Na2CO3,在电离理论中称为盐,但酸碱质子理论则认为CO32-是碱,而Na+是非酸非碱物质。,酸碱半反应式,仅仅是酸碱共轭关系的表达形式,并不是一种实际反应式.,例如HAc在水溶液中是酸,HAc H+ + Ac-,H2O + H+ H3O +,酸碱反应的实质是两对共轭酸碱对之间的质子传递反应。,如:,电离反应,扩大酸碱反应的范围,中和,水解,酸碱反应在非水体系下也能进行:,(二) 酸碱的强弱,用解离平衡常数衡量。,不仅与酸碱的本性有关,而且也与溶剂的性质密切相关,在H2O中表现出来的相对强度,没有绝对的酸、碱,更没绝对的强酸、强碱,1.酸的解离平衡常数Ka, 碱的解离平衡常数Kb,Ka 越大,酸性越强,Kb 越大,碱性越强,Ka 称酸常数,Kb称碱常数,(三) 共轭酸碱对的 Ka 和 Kb 的关系,Ka与Kb成反比关系,反映了在共轭酸碱对中,酸的强度大,其共轭碱的强度小,反之亦然。,(五)溶剂的拉平效应和区分效应,1.拉平效应,将不同强度的酸拉平到溶剂
4、化质子水平的效应称为拉平效应。具有拉平效应的溶剂称为拉平溶剂。,例如:,HCl和HAc是两种强度显著不同的酸,但在液氨中均表现出强酸性。,由于NH3接受质子的能力强,上述两个反应向右进行得很完全,以致HCl和HAc都被转变成同一种酸(氨合质子即铵离子NH4+),即它们在液氨中统统被拉平到NH4+的强度水平,故二者不存在强度上的差异。,液氨是HCl和HAc的拉平溶剂,2.区分效应,能把各种不同酸的强度区别开来的效应称为区分效应。具有区分效应的溶剂叫做区分溶剂。,例如:,HNO3、H2SO4、HCl和HClO4这四种酸在冰醋酸中是不同强度的酸,因为:,显然,酸的强度:HClO4H2SO4HClHNO3,冰醋酸的碱性较水弱,冰醋酸是上述四种酸的区分溶剂,酸碱质子理论,酸碱质子理论扩大了酸碱的含义和酸碱反应的范围,摆脱了酸碱必须在水中发生的局限性,解决了一些非水溶剂或气体间的酸碱反应,并把水溶液中进行的离子反应系统地归纳为质子传递的酸碱反应。,这样,加深了人们对于酸碱和酸碱反应的认识。关于酸碱的定量标度问题,酸碱质子理论亦能象解离理论一样,应用平衡常数来定量地衡量在某溶剂中酸或碱的强度,这就使
《无机化学:电解质溶液》由会员hu****a8分享,可在线阅读,更多相关《无机化学:电解质溶液》请在金锄头文库上搜索。

《小学生防溺水安全教育班会》教案

《中小学预防传染病知识主题班会》教案

《幼儿园防溺水安全教育班会》教案模板

小学开学第一课主题班会教案八篇

垃圾分类主题班会《保护环境 美化校园》教案

小学开学第一课主题班会教案和含演讲稿
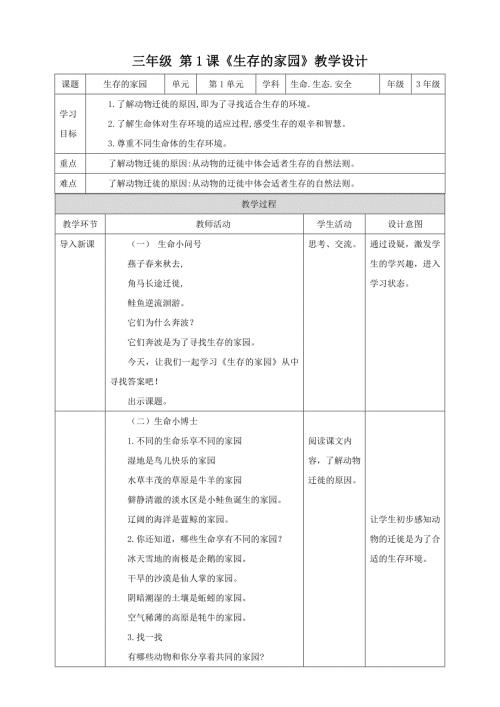
第1课《生存的家园》教学设计
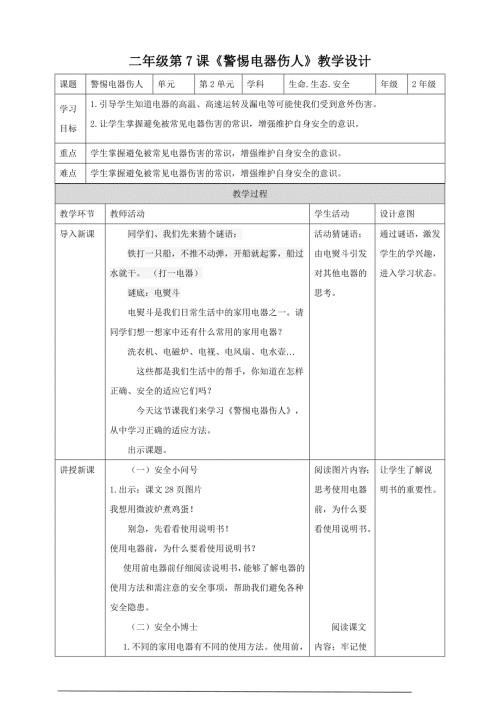
第7课《警惕电器伤人》教学设计
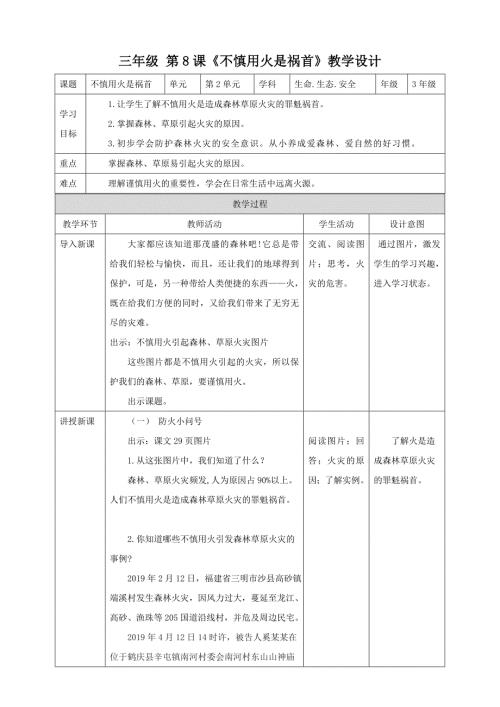
第8课《不慎用火是祸首》教学设计
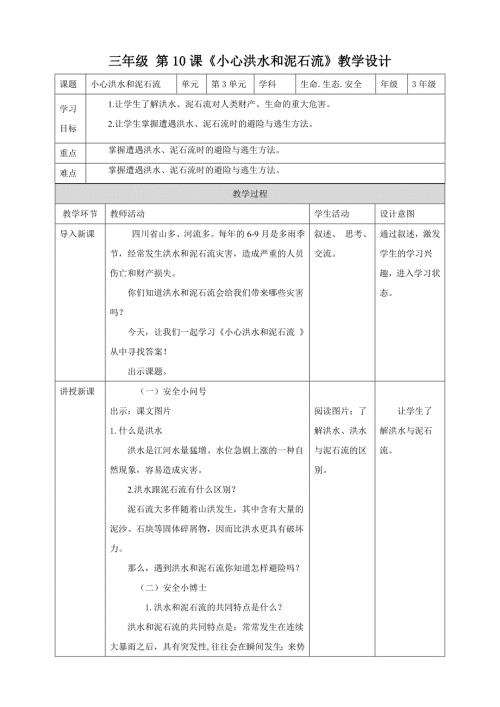
第10课《小心洪水和泥石流》教学设计
第11课《及时治小伤》教学设计
第1课《身体里的“乐队”》教案
第6课《校园避震有办法》教学设计
第18课《有你有我真温暖》教学设计
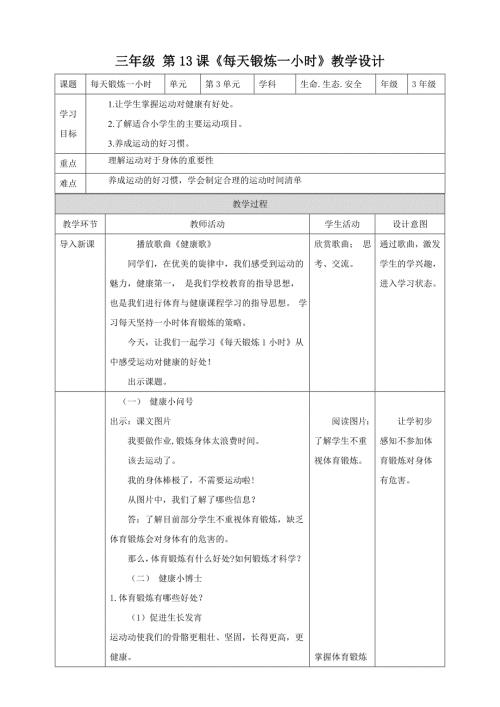
第13课《每天锻炼一小时》教学设计
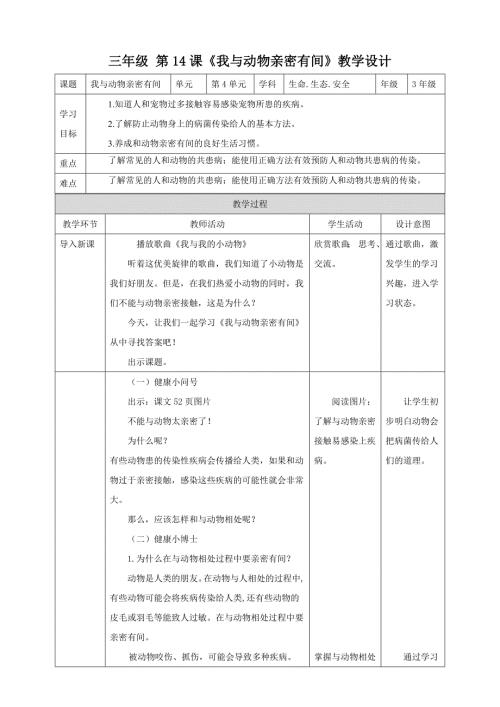
第14课《我与动物亲密有间》教学设计
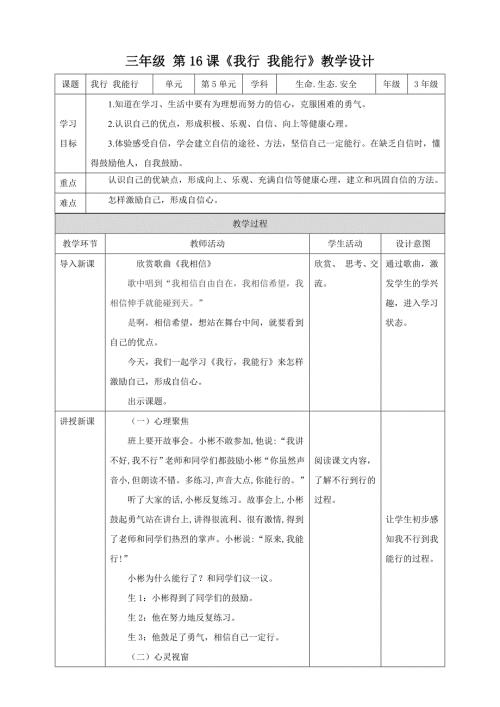
第16课《我行我能行》教学设计
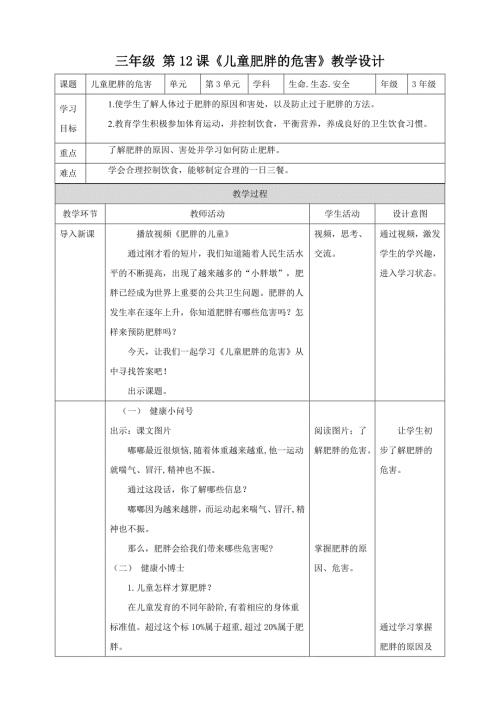
第12课《儿童肥胖的危害》教学设计

第17课《美丽的插花》教学设计

第8课《我和规则做朋友》教学设计
 突发新冠疫情封闭式管理应急预案培训
突发新冠疫情封闭式管理应急预案培训
2024-04-08 16页
 医生护士培训课件:心力衰竭病理诊断治疗
医生护士培训课件:心力衰竭病理诊断治疗
2024-04-08 55页
 医疗培训课件:护理护士岗位职责
医疗培训课件:护理护士岗位职责
2024-04-06 35页
 医院护士护理培训课件:疼痛管理
医院护士护理培训课件:疼痛管理
2024-04-06 38页
 医院医疗保护性约束的基础护理培训课件
医院医疗保护性约束的基础护理培训课件
2024-04-06 25页
 医疗垃圾的分类及处理垃圾分类专题培训
医疗垃圾的分类及处理垃圾分类专题培训
2024-04-06 22页
 医院医疗导师带徒工作汇报课件
医院医疗导师带徒工作汇报课件
2024-04-06 17页
 医疗培训课件:护士岗位职责
医疗培训课件:护士岗位职责
2024-03-21 31页
 医疗医院年终工作总结课件
医疗医院年终工作总结课件
2024-03-21 33页
 护理应知应会培训课件
护理应知应会培训课件
2024-02-20 68页

