
铬与其化合物性质(补充))
10页1、高三8班常考元素知识补充-铬铬及其化合物性质一、 单质:铬1、物理性质 铬是银白色的金属,难熔(熔点1800),比重为7.1,和铁差不多。铬是最硬的金属! 铬的化学性质很稳定,在常温下,放在空气中或浸在水里,不会生锈。手表的外壳常是银闪闪的,人们说它是镀了“克罗米”,共实,“克罗米”就是铬,是从路的拉丁文名称Chromium音译而来的。一些眼镜的金属架子、表带、汽车车灯、自行车车把与钢圈、铁栏杆、照相机架子等,也都常镀一层铬,不仅美观,而且防锈。所镀的铬层越薄,越是会紧贴在金属的表面,不易脱掉。在一些炮筒、枪管内壁,所镀的铬层仅有0.005毫米厚,但是,发射了千百发炮弹、子弹以后,铬层依然还在。五光十色。铬的希腊文原意,便是“颜色”。金属铬是雪白银亮的,硫酸铬是绿色的,铬酸镁是黄色的,重铬酸钾是桔红色的,铬酸是猩红色的,氧化铬是绿色的(常见的绿色颜料“铬绿”就是它),铬矾(含水硫酸铬)是蓝紫色的,铬酸铅是黄色的(常见的黄色颜科“铬黄”就是它)2、铬的化学性质不活泼金属,在常温下对氧和湿气都是稳定的,但和氟反应生成CrF3。金属铬在酸中一般以表面钝化为其特征。一旦去钝化后,极易溶解于几乎
2、所有的无机酸中,但不溶于硝酸。在高温下,铬与氮起反应并被碱所侵蚀。可溶于强碱溶液。铬具有很高的耐腐蚀性,在空气中,即便是在赤热的状态下,氧化也很慢。不溶于水。镀在金属上可起保护作用。温度高于600时铬和水、氮、碳、硫反应生成相应的Cr2O3,Cr2N和CrN, Cr7C3和Cr3C2,C r2S3。铬和氧反应时开始较快,当表面生成氧化薄膜之后速度急剧减慢;加热到1200时,氧化薄膜破坏,氧化速度重新加快,到2000时铬在氧中燃烧生成Cr2O3。铬很容易和稀盐酸或稀硫酸反应,生成氯化物或硫酸盐,同时放出氢气。相关化学方程式如下:Cr + 2HCl= CrCl2 + H2 Cr + H2SO4 = CrSO4 + H2二、重要化合物1、Cr(III) (1)Cr2O3 是绿色颜料,俗称“铬绿”,它是一种两性氧化物,能与酸或浓碱溶液反应。(同氧化铝) 氧化铬的制备:(NH4)2 Cr2O7 晶体受热即可分解出:Cr2O3 N2 H2O (2)Cr3+ 在酸性溶液中比较稳定,需要用强氧化剂方能使其氧化,比如酸性高猛酸钾溶液氧化成重铬酸根离子。 (3)CrO2-在碱性条件中是较强还原剂,如在碱性
《铬与其化合物性质(补充))》由会员suns****4568分享,可在线阅读,更多相关《铬与其化合物性质(补充))》请在金锄头文库上搜索。

土地管理与地籍测量---第八章界址点测量
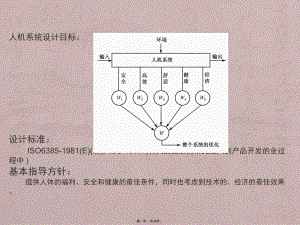
人机工程学案例分析(2)

工程安全培训_201303

第9章房地产投资决策分析

第2章房地产经纪制度

ACM程序设计-东北林业大学acm05

《亲爱的汉修先生》读书交流会

中原_深圳新世界尖岗山项目市场汇报_40P_2012年_别墅_项目分析_量价走势

五年级数学质量分析演示文稿

人工智能小镇-智慧小镇建设20180525

景观基本知识及发展历程

建设工程信息管理(2)

机电驱动技术第二章步进驱动技术
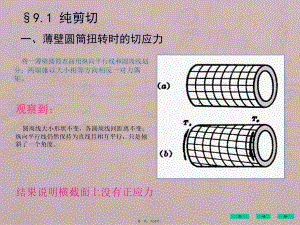
工程力学-第9章圆轴扭转时的应力变形分析与强度刚度设计

第一章第二节幼儿园文化环境建设的原则

第一章检测技术的基础知识

第一章__现代表面工程技术

第六章钢结构工程

第9节项目试运行管理

班主任工作经验交流课件(4)
 DSP在现代测控技术中的应用课程设计
DSP在现代测控技术中的应用课程设计
2023-08-11 2页
 CAM课程设计 (3)
CAM课程设计 (3)
2023-08-11 3页
 HTML5+CSS3网页设计案例教程课程设计 (2)
HTML5+CSS3网页设计案例教程课程设计 (2)
2023-08-11 2页
 ProbabilityandRandomProcessesforElectricalandcomputerEngineersCambridge教学设计 (2)
ProbabilityandRandomProcessesforElectricalandcomputerEngineersCambridge教学设计 (2)
2023-08-11 3页
 EDA技术实用教程第三版课程设计
EDA技术实用教程第三版课程设计
2023-08-11 4页
 Oracle11g中文版数据库管理应用与开发标准教程课程设计
Oracle11g中文版数据库管理应用与开发标准教程课程设计
2023-08-11 3页
 Android从入门到精通课程设计
Android从入门到精通课程设计
2023-08-11 4页
 20世纪外国文学作品选上卷教学设计
20世纪外国文学作品选上卷教学设计
2023-08-11 2页
 MFCWindows应用程序设计第三版教学设计
MFCWindows应用程序设计第三版教学设计
2023-08-11 4页
 CAM教学设计
CAM教学设计
2023-08-11 3页

