
高三一轮复习镁铝与其化合物
23页1、高三一轮复习,镁、铝及其化合物,1.掌握镁、铝性质、用途及其冶炼方法; 2.掌握MgO、Al2O3、Mg(OH)2、Al(OH)3 Al3+盐、AlO2盐的性质; 3.熟练应用镁、铝及其化合物的性质来解决 相关图像、推断等问题。,学习目标,一. Mg、Al的物理性质,铝比镁硬度稍大、熔沸点稍高 (铝中金属键比镁强),(1)共性:,银白色轻金属固体,熔点较低,硬度较小, 密度较小,有良好的导电、导热、延展性和韧性。,(2)异性:,二. Mg、Al的原子结构,三. Mg、Al的化学性质,与冷水缓慢反应 与沸水显著反应,与冷水不反应 与沸水缓慢反应,1.和水反应,考虑:镁条着火时,应采取何措施将其扑灭?能否用水?能否用泡沫灭火器?,Mg + 2H2O = Mg(OH)2 +H2,2.和碱反应,2Al + 2H2O + 2NaOH = 2NaAlO2+3H2,镁不与碱反应,a.和非氧化性酸反应(盐酸、稀硫酸等),3.和酸反应,b.和氧化性酸反应(硝酸、浓硫酸等),思考:(1)Mg粉加入至NH4Cl中可能有几种气体产 生?请说明理由,解析:将镁粉加入NH4Cl溶液中,有氢气和刺激性的氨气生成,这
2、是由于NH4Cl水解呈酸性,镁与水解产生的H+反应生成氢气破坏了NH4Cl水解平衡,NH3H2O浓度不断增大而分解放出NH3,同时还产生Mg(OH)2白色沉淀。反应的化学方程式可表示为:,Mg + 2NH4Cl = 2NH3+MgCl2 +H2 ( Mg2+ + 2OH = Mg(OH)2 ),4.与非金属单质的反应,Mg3N2 + 3H2O = 3Mg(OH)2 + 2NH3,5.与某些氧化物反应,铝热反应 用途、引发,反应现象:镁条剧烈燃烧,放出大量的热,发出耀眼的白光,纸漏斗内剧烈反应,纸漏斗被烧穿,有熔融物落入沙中。,四. 镁铝化合物的性质,(一)氧化物的对比,相同点:都是离子化合物,熔点高,化学性质活泼,可作为耐火材料。,Al2O3 + 6H+ =2Al3+3H2O,Al2O3 + 2OH- = 2AlO2- + H2O,不同点:MgO与水缓慢化合;Al2O3与水不反应。,氧化镁是碱性氧化物,可以和酸反应; 而氧化铝是两性氧化性:,(二)氢氧化物的对比,相同点:热稳定性差,加热易分解。,不同点:,Mg(OH)2是中强碱,可以使酚酞变浅红色,而Al(OH)3是弱碱,不能使酚酞变
《高三一轮复习镁铝与其化合物》由会员suns****4568分享,可在线阅读,更多相关《高三一轮复习镁铝与其化合物》请在金锄头文库上搜索。

土地管理与地籍测量---第八章界址点测量
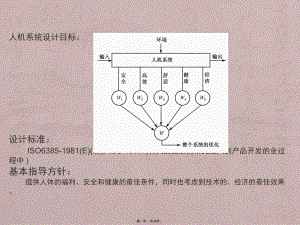
人机工程学案例分析(2)

工程安全培训_201303

第9章房地产投资决策分析

第2章房地产经纪制度

ACM程序设计-东北林业大学acm05

《亲爱的汉修先生》读书交流会

中原_深圳新世界尖岗山项目市场汇报_40P_2012年_别墅_项目分析_量价走势

五年级数学质量分析演示文稿

人工智能小镇-智慧小镇建设20180525

景观基本知识及发展历程

建设工程信息管理(2)

机电驱动技术第二章步进驱动技术
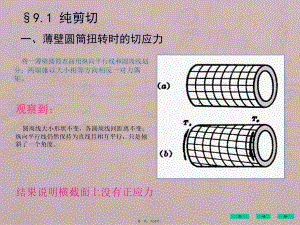
工程力学-第9章圆轴扭转时的应力变形分析与强度刚度设计

第一章第二节幼儿园文化环境建设的原则

第一章检测技术的基础知识

第一章__现代表面工程技术

第六章钢结构工程

第9节项目试运行管理

班主任工作经验交流课件(4)
 开学第一课安全教育-主题班会教育教学课件
开学第一课安全教育-主题班会教育教学课件
2024-04-09 29页
 高中英语元宵节猜灯谜活动英文课件
高中英语元宵节猜灯谜活动英文课件
2024-04-08 25页
 部编版高一语文上册(必修一)《“探界者”钟扬》课件
部编版高一语文上册(必修一)《“探界者”钟扬》课件
2024-04-08 13页
 部编版高一语文上册(必修一)《读书:目的和前提》课件
部编版高一语文上册(必修一)《读书:目的和前提》课件
2024-04-08 17页
 部编版高一语文上册(必修一)《喜看稻菽千重浪——记首届国家最高科技奖获得者袁隆平》课件
部编版高一语文上册(必修一)《喜看稻菽千重浪——记首届国家最高科技奖获得者袁隆平》课件
2024-04-08 17页
 部编版高一语文上册(必修一)《立在地球边上放号》课件
部编版高一语文上册(必修一)《立在地球边上放号》课件
2024-04-08 11页
 部编版高一语文上册(必修一)《峨日朵雪峰之侧》课件
部编版高一语文上册(必修一)《峨日朵雪峰之侧》课件
2024-04-08 14页
 部编版高一语文上册(必修一)《沁园春长沙》课件
部编版高一语文上册(必修一)《沁园春长沙》课件
2024-04-08 17页
 部编版高一语文上册(必修一)《拿来主义》课件
部编版高一语文上册(必修一)《拿来主义》课件
2024-04-08 15页
 部编版高一语文上册(必修一)《红烛》课件
部编版高一语文上册(必修一)《红烛》课件
2024-04-08 16页

