
物理化学电解质溶液.ppt
49页1、第5章 电解质溶液 Solution of Electrolyte,本章教学目标,理解原电池与电解池的异同点;,掌握离子迁移数、电导、电导率、摩尔电导率、 活度、离子平均活度和离子平均活度系数的概 念及计算;,掌握电导的应用。,了解离子独立运动定律;,化学能,电解池,原电池,电 能,电化学是研究化学能和电能之间相互转化规律的科学。,电化学的用途,电分析 生物电化学,电解质溶液是离子导电体,依靠溶液中离子迁移而导电,导电的同时在电极上发生化学反应。,5.1.1 电解质溶液的导电机理,1.电解池 2. 原电池,正极,正极,负极,负极,正极(positive electrode)电势高的电极 负极(negative electrode)电势低的电极,阳极 (anode)发生氧化作用的电极 阴极(cathode)发生还原作用的电极,原电池:化学能转化为电能的装置; 电解池:电能转化为化学能的装置。,原电池:负阳氧 电解池:正阳氧,结论: 失升氧,得降还; 正高负低,阳氧阴还; 电解池正阳负阴,原电池负阳正阴。,电解质溶液的导电机理: 在外电源电场的作用下,电解质溶液的正负离子分别向两个电极移动
2、,迁移到电极附近的离子分别在两个电极上进行氧化或还原作用,q 通过的电量(C) n发生反应的物质的量(mol) z离子电荷数 F法拉第常数(96485C.mol-1),通过电极的电量正比于电极反应的物质的量与电极反应电荷数的乘积,5.1.2 法拉第定律,例一: 通电于Au(NO3)3溶液,析出Au(s)=1.20g。已知M(Au)=197.0g/mol。求通入电量。,解:,阴离子(anion)阳极(anode) 阳离子(cation)阴极(cathode),5.1.3 离子的电迁移,1.离子淌度,:离子迁移速率,: 电势梯度,式中U称为离子淌度,其物理意义是电势梯度为单位数值时的离子迁移速率,其单位是m2V-1s-1。,离子淌度与离子的本性(离子半径、所带电荷)以及溶液的黏度及温度有关。,通入4mol 电 量,迁移过程:q+ q q,2.离子迁移数,通入4mol电量,迁移过程:q+ qq,定义:电解质溶液中各种离子的导电份额或导电百分数,用tB 表示,tB无量纲。,qBB种离子传输的电量 q通过溶液的总电量,对于只含有一种正离子和一种负离子的电解质溶液而言,正、负离子的迁移数分别为,t
3、+ + t- = 1,迁移数与淌度间的关系为,迁移数反映出离子承担运载电量的比例;,离子迁移率反映出离子在一定电场条件下的定向移动的快慢程度;,离子迁移率越大,该离子的迁移数就越大;,简言之:在电场中,哪种离子定向移动得越快,该离子对电流的传输所做的贡献就越大。,5.2 电导及其应用,电导(conductance) :电阻的倒数,单位用S表示。 G = 1 / R,溶液电导G与电极截面积成正比,与两电极间距离成反比。,5.2.1 电导、电导率与摩尔电导率,电导率的定义,摩尔电导率m,图5-3 摩尔电导率的定义,两相距1m平行电极间,1mol电解质溶液所具有的电导。,1mol电解质溶液的体积 V=1/c,m的单位为Sm2mol-1; c为溶液中电解质的浓度,单位为molm-3。,I 是频率在1000Hz左右的高频交流电源,G为高灵敏检流计。,接通电源后,移动C点,使DGC线路中无电流通过,即G显示为零时,D和C两点电位降相等,电桥达平衡。根据几个电阻之间关系就可求得待测溶液的电导。,R1为可变电阻,M为放有待测溶液的电导池, RX 电阻待测,5.2.2 电导的测定,单位是m-1,通常用已
4、知电导率的KCl溶液注入电导池,测定电阻后得到Kcell。,电导池常数(cell constant),用一电解池在298K测得0.02mol.dm-3KCl溶液电阻为82.4,浓度为0.0050mol.dm-3的1/2K2SO4溶液电阻为326。试求(1)电导池常数Kcell;(2) 0.0050mol.dm-3的1/2K2SO4溶液电导率和摩尔电导率m。,例 5- 1,5.2.3强电解质溶液电导率、摩尔电导率与浓度,电导率、摩尔电导率都是衡量电解质溶液导电能力的物理量。溶液的浓度和电导率、摩尔电导率有着 什么样的关联呢?,1.电导率与浓度的关系,强电解质溶液:随C的增加而升高。当C增加到一定程度后,离子相互作用加强,离子运动速率降低,也降低,如H2SO4和KOH溶液。,弱电解质溶液: 随C变化不显著,因C增加使其电离度下降,粒子数目变化不大,如醋酸。,中性盐:由于受饱和溶解度的限制,浓度不能太高,如KCl。,由于溶液中导电物质的量已给定为1mol,所以,当浓度降低时,粒子之间相互作用减弱,正、负离子迁移速率加快,溶液的摩尔电导率必定升高。,浓度很稀的强电解质溶液,将直线外推至C0,
《物理化学电解质溶液.ppt》由会员飞****9分享,可在线阅读,更多相关《物理化学电解质溶液.ppt》请在金锄头文库上搜索。

2019年抚顺市第六中学高考生物简单题专项训练(含解析)

2019年教科版八年级物理上册全册学案

2019年宝鸡晨光中学高考生物简单题专项训练(含解析)

2019年象山港书院高考生物简单题专项训练(含解析)

2019年一级建造师工程经济考点总结

2019年小学教育教学工作总结4篇

2019年浙江省金华市中考数学试卷(解析版)
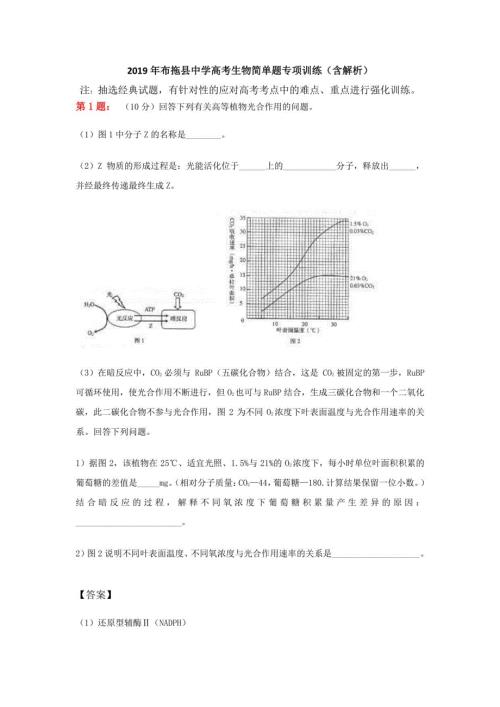
2019年布拖县中学高考生物简单题专项训练(含解析)

2010年卫生系列中级职称内科学风湿及结缔组织病习题及参考答案
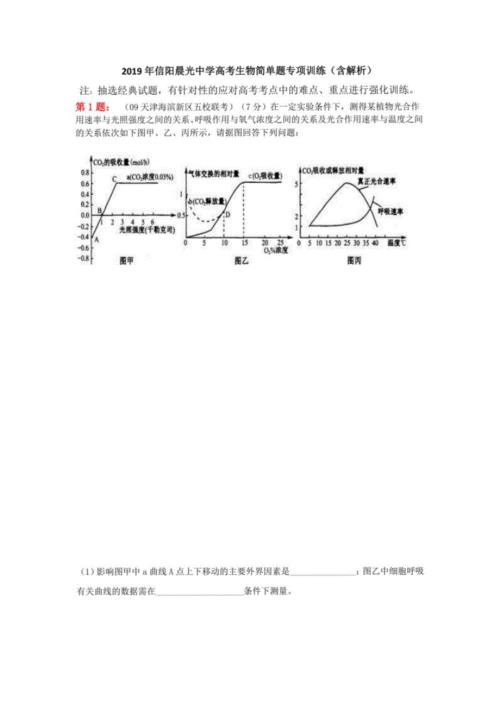
2019年信阳晨光中学高考生物简单题专项训练(含解析)

2018年一级建造师市政实务必考点

2019年和县第三中学高考生物简单题专项训练(含解析)

2018高考化学微题型微考点训练1--20

2019年大理市大理第二中学高考生物简单题专项训练(含解析)
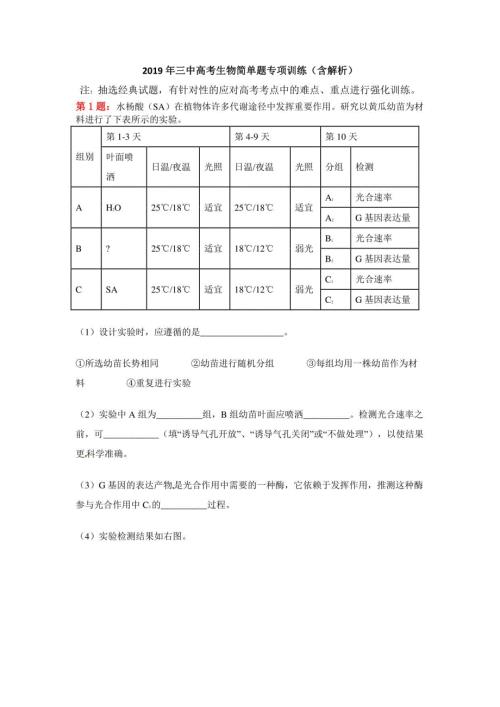
2019年三中高考生物简单题专项训练(含解析)

2018检验检测机构质量手册

2019年衡南县第三中学高考生物简单题专项训练(含解析)

2019年宏华中学高考生物简单题专项训练(含解析)

2018年银行从业资格考试个人贷款考点重点难点总结

2018全省行政执法资格模拟考试试题
 应对行业变革挑战策略
应对行业变革挑战策略
2024-04-11 25页
 应对经济环境变化的策略布局(资料)
应对经济环境变化的策略布局(资料)
2024-04-11 37页
 并购重组项目总结与反思
并购重组项目总结与反思
2024-04-11 28页
 年度财务审计报告解读(资料)
年度财务审计报告解读(资料)
2024-04-11 31页
 年度品牌影响力报告(资料)
年度品牌影响力报告(资料)
2024-04-11 36页
 市场趋势分析与预测会议
市场趋势分析与预测会议
2024-04-11 29页
 市场调研报告及趋势预测(资料)
市场调研报告及趋势预测(资料)
2024-04-11 22页
 市场调研中的伦理与法律问题
市场调研中的伦理与法律问题
2024-04-11 27页
 市场营销趋势与消费者行为分析会议
市场营销趋势与消费者行为分析会议
2024-04-11 34页
 市场营销扩大商业影响力
市场营销扩大商业影响力
2024-04-11 32页

