
粒子半径大小的比较规律.doc
3页1、 粒子半径大小的比较规律原子和简单离子半径大小的比较是高考的一个重要考点,掌握比较的方法和规律,才能正确判断粒子半径的大小。中学化学里常见粒子半径大小比较,规律如下:1.同种元素粒子半径大小比较:同种元素原子形成的粒子,核外电子数越多,粒子半径越大。阳离子半径小于相应原子半径。如r(Na+)r(Cl);同种元素不同价态的离子,价态越高,离子半径越小。如r(Fe)r(Fe2+)r(Fe3+)、r(H) r (H) r(H+)。2.不同元素粒子半径的比较:同周期元素,电子层数相同,原子序数越大,原子半径、最高价阳离子半径、最低价阴离子半径均逐渐减小(仅限主族元素)。如r(Na)r(Mg)r(Al)r(S)r(Cl)、r(Na+) r(Mg2+)r(Al3+)、r(O2) r(F)。同一周期各元素,阴离子半径一定大于阳离子半径。如r(O2) r(Li+)。同主族元素,最外层电子数相同,电子层数越多,原子半径越大,同价态的离子半径大小也如此。如:r(F)r(Cl)r(Br)r(I),r(F)r(Cl)r(Br)r(I),r(Li+)r(Na+)r(Cl)r(Ar) r(K+)r(Ca2+)、r
2、(O2) r(F) r(Na+) r(Mg2+) r(Al3+)。稀有气体元素的原子,半径比与它相邻的卤素原子的原子半径大,如r(Ar) r(Cl)。 核电荷数、电子层数、电子数都不相同的粒子,一般可以通过一种参照粒子进行比较。如铝原子和氧原子,可以通过硼原子转换,r(Al)r(B) r(O),也可以通过硫原子转换,r(Al)r(S) r(O)。微粒半径大小的比较方法1原子半径的大小比较,一般依据元素周期表判断。若是同周期的,从左到右,随着核电荷数的递增,半径逐渐减小;若是同主族的,从上到下,随着电子层数增多,半径依次增大。2若几种微粒的核外电子排布相同,则核电荷数越多,半径越小。3同周期元素形成的离子中阴离子半径一定大于阳离子半径,因为同周期元素阳离子的核外电子层数一定比阴离子少一层。4同种金属元素形成的不同金属离子,其所带正电荷数越多(失电子越多),半径越小。判断微粒半径大小的总原则是:1电子层数不同时,看电子层数,层数越多,半径越大;2电子层数相同时,看核电荷数,核电荷数越多,半径越小;3电子层数和核电荷数均相同时,看电子数,电子数越多,半径越大;如r(Fe2+) r(Fe3+)
《粒子半径大小的比较规律.doc》由会员灯火****19分享,可在线阅读,更多相关《粒子半径大小的比较规律.doc》请在金锄头文库上搜索。

2019年湘阴县第三中学高考生物简单题专项训练(含解析)

2019年耿马县民族中学高考生物简单题专项训练(含解析)

2019年楚雄师院附中高考生物简单题专项训练(含解析)

2019年桥梁工程师年终总结
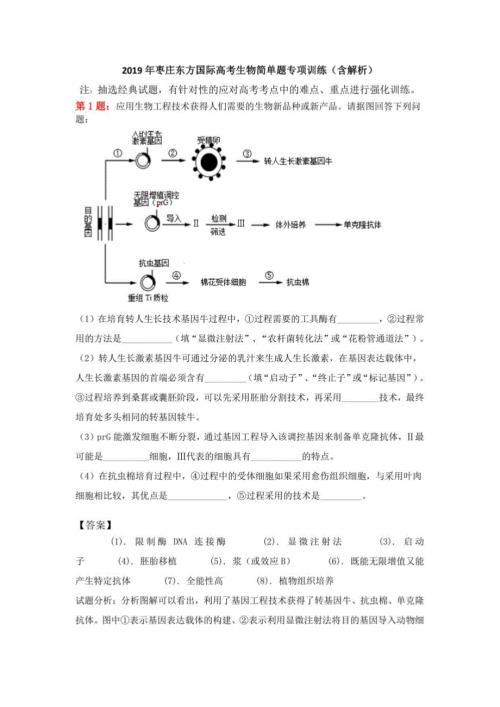
2019年枣庄东方国际高考生物简单题专项训练(含解析)

2018年一级建造师公路工程实务考点归纳

2019年赣榆县高考生物简单题专项训练(含解析)

2019年春湾中学高考生物简单题专项训练(含解析)

高考地理复习汇总

2019年朝鲜中学高考生物简单题专项训练(含解析)

2019年沧州市运河区派尼中学高考生物简单题专项训练(含解析)

2018年甘肃公务员《行政职业能力测验》试题(网友回忆版)

宾语从句 (解析卷)---2023年中考英语考点详解+专项训练

2018年一级建造师通信与广电实务考点

2019年湖北省襄阳市中考数学试卷(解析版)

文言文阅读(解析版)

中医综合模拟试卷343

2019年单县第二中学高考生物简单题专项训练(含解析)

二级法规考点解析1

2019年低碳经济继续教育模拟考试题库500题(含标准答案)
 2024年安徽省芜湖市中考二模语文试卷【含答案】
2024年安徽省芜湖市中考二模语文试卷【含答案】
2024-04-24 10页
 2024届河北省邯郸市中考一模语文试题【含答案】
2024届河北省邯郸市中考一模语文试题【含答案】
2024-04-24 10页
 2024年(6月份)中考数学押题试卷【含答案】
2024年(6月份)中考数学押题试卷【含答案】
2024-04-24 25页
 2024年江苏省扬州市宝应县中考一模语文试题【含答案】
2024年江苏省扬州市宝应县中考一模语文试题【含答案】
2024-04-24 10页
 辽宁省本溪市2022-2023学年高中下学期学业水平考试美术试题【含答案】
辽宁省本溪市2022-2023学年高中下学期学业水平考试美术试题【含答案】
2024-04-23 4页
 第六单元 正比例和反比例 (单元测试卷)苏教版数学六年级下册【含答案】
第六单元 正比例和反比例 (单元测试卷)苏教版数学六年级下册【含答案】
2024-04-23 10页
 江苏省无锡市2024年七年级下学期期中数学调研试卷【含答案】
江苏省无锡市2024年七年级下学期期中数学调研试卷【含答案】
2024-04-23 19页
 江苏省江阴市华士片2022-2023学年七年级下学期期中语文试题【含答案】
江苏省江阴市华士片2022-2023学年七年级下学期期中语文试题【含答案】
2024-04-23 10页
 江苏省泰州兴化市2023-2024学年高一下学期期中考试语文试题【含答案】
江苏省泰州兴化市2023-2024学年高一下学期期中考试语文试题【含答案】
2024-04-23 16页
 小学六年级体育与健康测试题【含答案】
小学六年级体育与健康测试题【含答案】
2024-04-23 5页

