
课时达标训练(六) 化学反应的速率和限度.doc
7页1、课时达标训练(六)化学反应的速率和限度一、选择题1一定条件下发生反应N23H2 2NH3,在5 min内,N2的物质的量浓度由6 molL1变为2 molL1,则用NH3表示该反应在这段时间的平均速率为()A4 molL1min1B1.6 molL1min1C0.8 molL1min1 D0.6 molL1min12(海南高考)对于化学反应3W(g)2X(g)=4Y(g)3Z(g),下列反应速率关系中,正确的是()Av(W)3v(Z) B2v(X)3v(Z)C2v(X)v(Y) D3v(W)2v(X)3反应:3A(g)B(g)=2C(g)2D(g),在不同条件下,用不同物质表示其反应速率,分别为:v(A)0.6 molL1min1;v(B)0.45 molL1min1;v(C)0.015 molL1min1;v(D)0.45 molL1min1。则此反应在不同条件下进行最快的是()ABCD4如图所示,相同质量的铁和锌与足量的稀H2SO4充分反应,产生氢气的质量(m)与反应时间(t)的正确关系是()5对于可逆反应2SO2O2 2SO3,在混合气体中充入一定量的 18O2,足够长的时间后,
2、18O原子()A只存在于O2中B只存在于O2和SO3中C只存在于O2和SO2中D存在于SO2、O2和SO3中6(北京高考)一定温度下,10 mL 0.40 molL1 H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准标况)如下表。t/min0246810V(O2)/mL0.09.917.222.426.529.9下列叙述不正确的是(溶液体积变化忽略不计)()A06 min的平均反应速率:v(H2O2)3.3102molL1min1B610 min的平均反应速率:v(H2O2)3.3102molL1min1C反应至6 min时,c(H2O2)0.30 molL1D反应至6 min时,H2O2分解了50%7双选下列关于化学反应的限度的说法正确的是()A一个可逆反应达到的平衡状态,就是这个反应在该条件下所能达到的限度B当一个可逆反应达到平衡状态时,正、逆反应速率相等C平衡状态是一种静止的状态,反应物和生成物的浓度已经不再改变D化学反应的限度不可以通过改变条件而改变8在一密闭容器中进行反应:2SO2(g)O2(g)2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓
3、度分别为0.2 molL1、0.1 molL1、0.2 molL1,当反应达到平衡时,可能存在的数据是()ASO2为0.4 molL1,O2为0.2 molL1BSO2为0.25 molL1CSO2、SO3均为0.15 molL1DSO3为0.4 molL19在体积固定的容器中,对于反应A(g)B(g)3C(g)(正反应为放热反应),下述为平衡状态标志的是()单位时间内A、B生成C的分子数与分解C的分子数相等外界条件不变时,A、B、C浓度不随时间变化体系温度不再变化体系的压强不再变化 体系的分子总数不再变化A BC D10一定条件下,可逆反应2AB3C在四种状态中处于平衡状态的是()正反应速率逆反应速率Av(A)2 molL1min1v(B)2 molL1min1Bv(A)2 molL1min1v(C)2 molL1min1Cv(A)1 molL1min1v(B)2 molL1min1Dv(A)1 molL1min1v(C)1.5 molL1min111某温度时,在容积为3 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。由图中数据分析,下列结论错误的是()A该反
《课时达标训练(六) 化学反应的速率和限度.doc》由会员飞****9分享,可在线阅读,更多相关《课时达标训练(六) 化学反应的速率和限度.doc》请在金锄头文库上搜索。

2019年抚顺市第六中学高考生物简单题专项训练(含解析)

2019年教科版八年级物理上册全册学案

2019年宝鸡晨光中学高考生物简单题专项训练(含解析)

2019年象山港书院高考生物简单题专项训练(含解析)

2019年一级建造师工程经济考点总结

2019年小学教育教学工作总结4篇

2019年浙江省金华市中考数学试卷(解析版)
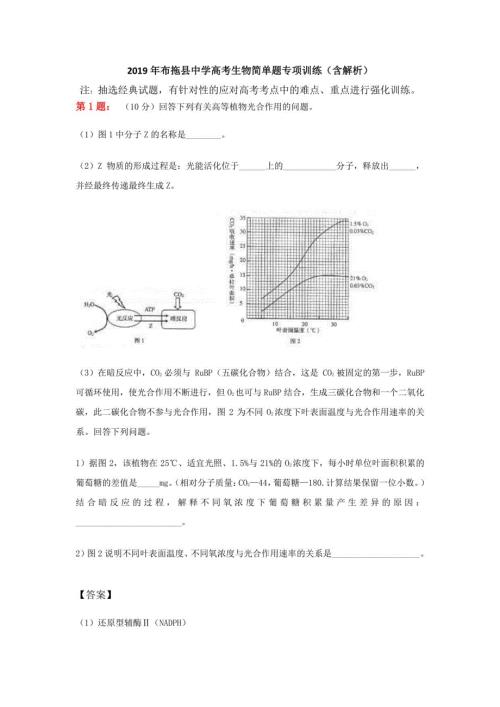
2019年布拖县中学高考生物简单题专项训练(含解析)

2010年卫生系列中级职称内科学风湿及结缔组织病习题及参考答案
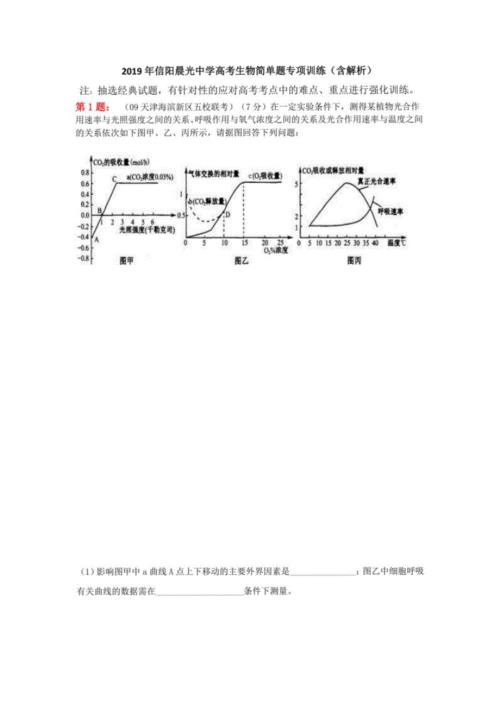
2019年信阳晨光中学高考生物简单题专项训练(含解析)

2018年一级建造师市政实务必考点

2019年和县第三中学高考生物简单题专项训练(含解析)

2018高考化学微题型微考点训练1--20

2019年大理市大理第二中学高考生物简单题专项训练(含解析)
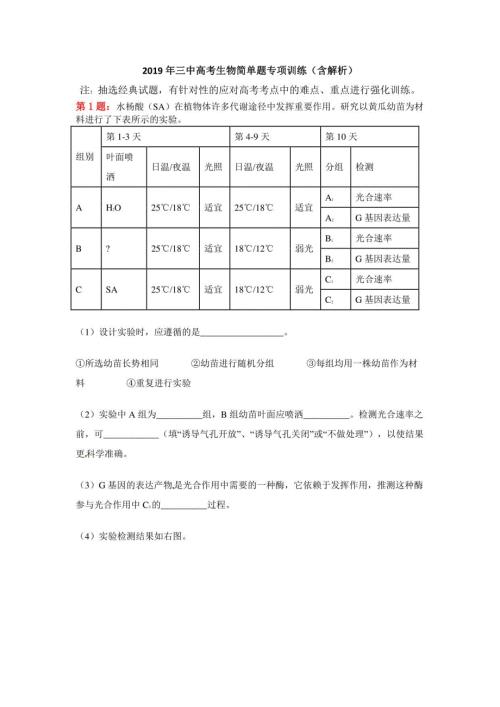
2019年三中高考生物简单题专项训练(含解析)

2018检验检测机构质量手册

2019年衡南县第三中学高考生物简单题专项训练(含解析)

2019年宏华中学高考生物简单题专项训练(含解析)

2018年银行从业资格考试个人贷款考点重点难点总结

2018全省行政执法资格模拟考试试题
 小数数学题:简便计算11道练习题及参考答案A10
小数数学题:简便计算11道练习题及参考答案A10
2024-04-17 2页
 小数数学题:简便计算11道练习题及参考答案A7
小数数学题:简便计算11道练习题及参考答案A7
2024-04-17 2页
 小数数学题:简便计算11道练习题及参考答案A3
小数数学题:简便计算11道练习题及参考答案A3
2024-04-17 2页
 小数数学题:简便计算11道练习题及参考答案A5
小数数学题:简便计算11道练习题及参考答案A5
2024-04-17 2页
 小数数学题:简便计算11道练习题及参考答案A9
小数数学题:简便计算11道练习题及参考答案A9
2024-04-17 2页
 小数数学题:简便计算11道练习题及参考答案A6
小数数学题:简便计算11道练习题及参考答案A6
2024-04-17 2页
 小数数学题:简便计算11道练习题及参考答案A8
小数数学题:简便计算11道练习题及参考答案A8
2024-04-17 2页
 小数数学题:简便计算11道练习题及参考答案A1
小数数学题:简便计算11道练习题及参考答案A1
2024-04-17 2页
 小数数学题:简便计算11道练习题及参考答案A4
小数数学题:简便计算11道练习题及参考答案A4
2024-04-17 2页
 小数数学题:简便计算11道练习题及参考答案A2
小数数学题:简便计算11道练习题及参考答案A2
2024-04-17 2页

