
高一化学模块I主解析
16页1、高一化学模块I主 要知识及化学方 程式 钠及其化合物的性质: 1 钠在空气中缓慢氧化:4Na+O2=2Na2O 2 钠在空气中燃烧:2Na+O2点燃=Na2O2 3 钠与水反应:2Na+2H2O=2NaOH+H2 现象:钠浮在水面上;熔化为银白色小球;在水面上四 处游动;伴有嗞嗞响声;滴有酚酞的水变红色。 4 过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2 5 过氧化钠与二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O2 6 碳酸氢钠受热分解:2NaHCO3=Na2CO3+H2O+CO2 7 氢氧化钠与碳酸氢钠反应:NaOH+NaHCO3=Na2CO3+H2O 8 在碳酸钠溶液中通入二氧化碳: Na2CO3+CO2+H2O=2NaHCO3 氯及其化合物的性质 1 氯气与氢氧化钠的反应: Cl2+2NaOH=NaCl+NaClO+H2O 2 铁丝在氯气中燃烧:2Fe+3Cl2点燃 =2FeCl3 3 制取漂白粉(氯气能通入石灰浆) 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 4 氯气与水的反应:Cl2+H2O=HClO+HCl 5 次氯酸钠在空
2、气中变质: NaClO+CO2+H2O=NaHCO3+HClO 6 次氯酸钙在空气中变质:Ca(ClO) 2+CO2+H2O=CaCO3+2HClO 以物质的量为中心的物理量关系 1 物质的量n(mol)= N/N(A) 2 物质的量n(mol)= m/M 3 标准状况下气体物质的量n(mol)= V/V(m) 4 溶液中溶质的物质的量n(mol)=cV 胶体: 1 定义:分散质粒子直径介于1100nm之 间的分散系。 2 胶体性质: 丁达尔现象 聚沉 电泳 布朗运动 3 胶体提纯:渗析 电解质和非电解质 1 定义:条件:水溶液或熔融状态;性质:能否导电;物质 类别:化合物。 2 强电解质:强酸、强碱、大多数盐;弱电解质:弱酸、弱碱、水 等。 3 离子方程式的书写: 写:写出化学方程式 拆:将易溶、易电离的物质改写成离子形式,其它以化学式形式 出现。 下列情况不拆:难溶物质、难电离物质(弱酸、弱碱、水等)、氧化 物、HCO3-等。 删:将反应前后没有变化的离子符号删去。 查:检查元素是否守恒、电荷是否守恒。 4 离子反应、离子共存问题:下列离子不能共存在同一溶液中: 生成难溶物质的离子
3、:如Ba2+与SO42-;Ag+与Cl-等 生成气体或易挥发物质:如H+与CO32-、HCO3-、SO32-、S2-等; OH-与NH4+等。 生成难电离的物质(弱电解质) 发生氧化还原反应:如:MnO4-与I-;H+、NO3-与Fe2+等 氧化还原反应 1 (某元素)降价得到电子 被还原作氧化剂产物为还原产 物 2 (某元素)升价失去电子 被氧化作还原剂产物为氧化产 物 3 氧化性:氧化剂氧化产物 还原性:还原剂还原产物 铁及其化合物性质 1 Fe2+及Fe3+离子的检验: Fe2+的检验:(浅绿色溶液) a) 加氢氧化钠溶液,产生白色沉淀,继而变灰绿色,最后变红褐色。 b) 加KSCN溶液,不显红色,再滴加氯水,溶液显红色。 Fe3+的检验:(黄色溶液) a) 加氢氧化钠溶液,产生红褐色沉淀。 b) 加KSCN溶液,溶液显红色。 2 主要反应的化学方程式: 铁与盐酸的反应:Fe+2HCl=FeCl2+H2 铁与硫酸铜反应(湿法炼铜):Fe+CuSO4=FeSO4+Cu 在氯化亚铁溶液中滴加氯水:(除去氯化铁中的氯化亚铁杂质) 3FeCl2+Cl2=2FeCl3 氢氧化亚铁在空气中变
《高一化学模块I主解析》由会员我**分享,可在线阅读,更多相关《高一化学模块I主解析》请在金锄头文库上搜索。

高三世界地理专题复习总论4天气与气候汇编

云南大学分析化学第五章 酸碱滴定

南京大学 刘金源教授多元新史观与世界史教学

南大门之不夜城

海南大学 食品分析七 2014

东南大学功放电路和直流电源(第29讲)2014

步步高·2015高三物理总复习(江苏专用)【配套课件】:第4章 曲线运动万有引力与航天 第1课时 曲线运动.

必修2:4.1曲线运动 运动的合成与分解【2015《物理复习方略》一轮复习课件沪科版】.
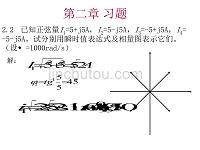
济南大学电工习题答案.

金版学案13-14物理(人教版)选修3-2课件:5.3电感和电容对交变电流的影响.

现代教学媒体.

教案4(火警报警系统).

湖南大学-物理 课程指导八.

语s版六年级下册语文百花园四课件剖析

世纪金榜2018版复习方略物理课件31.

人教新课标二年级语文下册《我不是最弱小的_5》PPT课件.

楼宇自动化 课件 教学PPT 作者 傅海军 第5章.

暨南大学-管理学-第11章-控制.

海南大学 食品分析十二 2014.

北师大八年级数学下册-第2课时-分式的基本性质.
 应对行业变革挑战策略
应对行业变革挑战策略
2024-04-11 25页
 应对经济环境变化的策略布局(资料)
应对经济环境变化的策略布局(资料)
2024-04-11 37页
 并购重组项目总结与反思
并购重组项目总结与反思
2024-04-11 28页
 年度财务审计报告解读(资料)
年度财务审计报告解读(资料)
2024-04-11 31页
 年度品牌影响力报告(资料)
年度品牌影响力报告(资料)
2024-04-11 36页
 市场趋势分析与预测会议
市场趋势分析与预测会议
2024-04-11 29页
 市场调研报告及趋势预测(资料)
市场调研报告及趋势预测(资料)
2024-04-11 22页
 市场调研中的伦理与法律问题
市场调研中的伦理与法律问题
2024-04-11 27页
 市场营销趋势与消费者行为分析会议
市场营销趋势与消费者行为分析会议
2024-04-11 34页
 市场营销扩大商业影响力
市场营销扩大商业影响力
2024-04-11 32页

