
物质结构与性质20171107
81页1、物质结构与性质,(一)原子结构与元素的性质 1了解原子核外电子的能级分布,能用电子排布式表示常见元素(136号)原子核外电子的排布。了解原子核外电子的运动状态。 2了解元素电离能的含义,并能用以说明元素的某些性质。 3了解原子核外电子在一定条件下会发生跃迁,了解其简单应用。 4了解电负性的概念,知道元素的性质与电负性的关系。,考纲要求,处于一定空间运动状态的单个电子在原子核外出现的概率密度分布可用 形象化描述。(P8),原子轨道的图形描述(P6),电子云,一、基态原子的核外电子排布,考点1、用电子排布式表示常见元素(136号)原子核外电子的排 布(考点:基态原子和离子的轨道表示式、核外电子排布式、 价电子排布式 ,必考),知识储备1:(P11-P13),基态原子的核外电子排布的原则,能量最低原则: 核外电子优先排布在能量低的轨道,然后排布在能量高的轨道。 泡利不相容原理: 一个原子轨道中最多只能容纳两个电子,并且这两个电子的自旋方向必须相反。 洪特规则: 对于基态原子,电子在能量相同的轨道上排布时,应尽可能的分占不同的轨道并且自旋方向相同。 洪特第二规则: 能量相同的原子轨道在全充满、
2、半充满和全空状态时,体系能量较低,原子较稳定。,能 量,鲍林近似能级图,知识储备2:(P15),轨道表示式 电子排布式,19K 20Ca 21Sc 22Ti 23V 24Cr 25Mn,Ar,4s,Ar,Ar,Ar4s1,4s,Ar4s2,Ar3d14s2,按构造原理在核外电子轨道上填入电子, 但书写电子排布式要按能层次序写。,Ar: 1s22s22p6 3s23p6,Ar,Ar,Ar3d24s2,Ar3d34s2,练习:1、写出第四周期元素原子的电子排布式、 轨道表示式,26Fe 27Co 28Ni 29Cu 30Zn,Ar3d64s2,Ar3d74s2,Ar3d84s2,Ar3d104s1,Ar3d104s2,电子排布式,31Ga 32Ge 33As 34Se 35Br 36Kr,Ar3d104s24p1,Ar3d104s24p2,Ar3d104s24p3,Ar3d104s24p4,Ar3d104s24p5,Ar3d104s24p6,练习:写出Fe2+、 Fe3+、Cu+、 Cu2+的电子排布式、 价电子排布式,Cu+: Ar3d10 3d10,Fe3+: Ar3d5 3d5,Fe
3、2+: Ar3d6 3d6,Ar3d64s2,26Fe,Cu2+: Ar3d9 3d9,Ar3d104s1,29Cu,离子的(价)电子排布式,原子电子排布式,知识储备3:(P13、 P15),价电子和价电子排布,三维P227,核外电子排布与周期表的分区(P16),s区 ns1-2,d区 (n-1)d1-8ns1-2,ds区 (n-1)d10ns1-2,s区,p区 ns2np1-6,f区,外围电子( 价电子)排布,三维P227,板书,一、基态原子的核外电子排布的原则,二、基态原子的核外电子排布的 1、(价)电子排布式,2、电子排布图(轨道表示式) 3、原子结构示意图,物质结构与性质,知识储备3:主族元素第一电离能的变化规律(P23),考点2了解元素电离能的含义,并能用以说明元素的某些性质。,知识储备1:电离能的定义及意义(P22),知识储备2:原子各级电离能的定义及意义(P22),P23,同主族元素,从上到下,失电子能力逐渐增强,第一电离能逐渐减小,同主族 (从上到下),(1)同周期元素,从左到右失电子能力逐渐减弱。 (2)IIA、VA族元素的价电子排布具有稳定结构,(1)总体上呈现由小
4、到大的变化趋势 (2)IIA、VA族元素较相邻元素的数值大,同周期 (从左到右),原因解释,I1规律, 3s23p1,3s23p2,3s23p3,3s23p4,2s22p3,第一电离能最大的是,三维P228,知识储备1:电负性的定义及意义(P25),知识储备2:主族元素电负性的递变规律(P25),同主族元素,从上到下吸引电子能力逐渐减弱,由大到小,同主族 (从上到下),同周期元素,从左到右吸引电子能力逐渐增强。,由小到大,同周期 (从左到右),原因解释,电负性规律,考点3:了解电负性的概念,知道元素的性质与电负性的关系。,考纲要求,(二)化学键与物质的性质 1理解离子键的形成,能根据离子化合物的结构 特征解释其物理性质。 2了解共价键的主要类型有键和键,能用键 能、键长、键角等说明简单分子的某些性质。 3了解原子晶体的特征,能描述金刚石、二氧化 硅等原子晶体的结构与性质的关系。 4理解金属键的含义,能用金属键理论解释金属 的一些物理性质。 5了解杂化轨道理论及常见的杂化轨道类型 ( sp , sp2, sp3) 6能用价层电子对互斥理论或者杂化轨道理论推 测常见的简单分子或者离子的空间
《物质结构与性质20171107》由会员简****9分享,可在线阅读,更多相关《物质结构与性质20171107》请在金锄头文库上搜索。

陕西旅游版小学四年级上册英语教案 全册

安师大化学教学论教案02化学教学实验设计

新人教版小学数学五年级上册教案 全册

教科版四年级下册科学全册教案7

新人教版小学一年级数学上册全册完整数学教案10

数学湘教版八年级下第22章《二次根式》复习教案

数学八年级上册第11章三角形 教案 新人教版 (二)
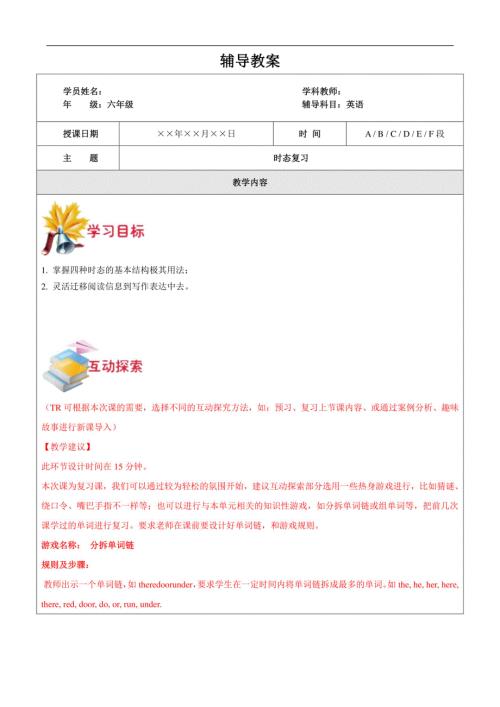
小学6年级英语教案:第12讲 时态复习

基础会计教案5-9章

新人教版二年级数学上册知识点总结及全册教案

果树栽培学教案果树栽培学教案

四年级下册语文教案设计(全)
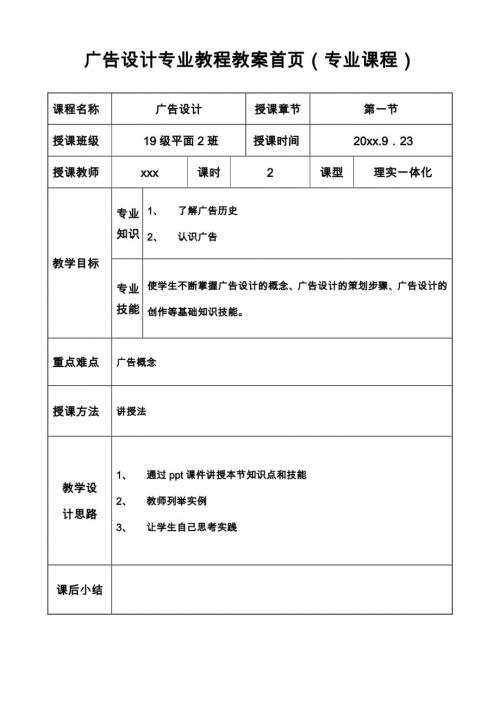
广告设计专业教程教案

小学体育教案全集1

闽教版(2021修订版)信息技术五年级下册教案

外研版七年级英语上册教案7

小学数学第09册教案(北师大版)

新人教三年级上册数学教案全册
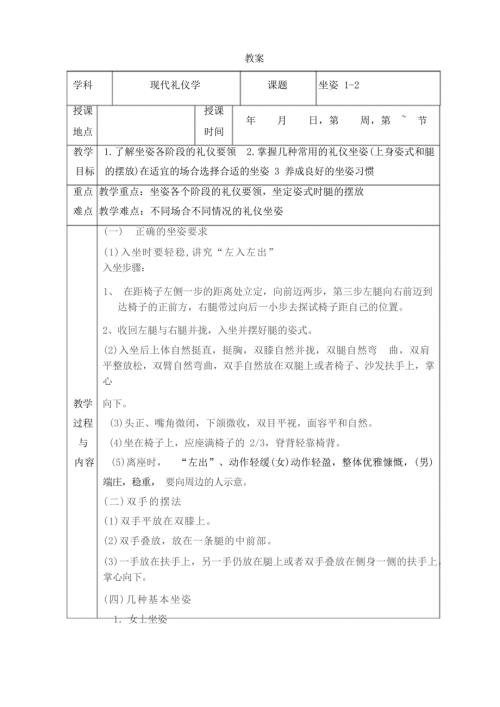
现代礼仪教案 坐姿教案

外研版小学英语三年级下册教案1
 企业高效开会秘诀
企业高效开会秘诀
2024-01-31 15页
 管理者的职责认知
管理者的职责认知
2024-01-31 21页
 高效会议秘诀培训PPT
高效会议秘诀培训PPT
2024-01-31 37页
 项目管理流程(5大过程)
项目管理流程(5大过程)
2024-01-31 30页
 商业分析工具:战略分析与规划工具(精品)
商业分析工具:战略分析与规划工具(精品)
2024-01-31 22页
 商业分析工具:由商业问题到最终成果
商业分析工具:由商业问题到最终成果
2024-01-31 48页
 管理者的自我成长
管理者的自我成长
2024-01-31 32页
 项目管理流程培训PPT
项目管理流程培训PPT
2024-01-31 40页
 商业分析工具:销售数据分析方法
商业分析工具:销售数据分析方法
2024-01-31 31页
 会议管理知识
会议管理知识
2024-01-31 20页

