
流行病学第17章药物流行病学
66页1、1,“海豹肢畸形”婴儿,生命斗士 尼克胡哲 2005年获得“杰出澳洲青年奖”。,3,20世纪50年代后期原联邦德国格仑南苏制药厂生产了一种声称治疗妊娠反应的镇静药Thalidomide(又称反应停、沙利度胺、肽咪哌啶酮)。实际这是一种100%的致畸胎药。该药出售后的6年间,先后在原联邦德国、澳大利亚、加拿大、日本以及拉丁美洲、非洲的共28个国家,发现畸形胎儿12000余例(其中西欧就有60008000例,日本约有1000例)。患儿无肢、短肢、肢间有蹼、心脏畸形等先天性异常,呈海豹肢畸形(phocornelia)。,“20世纪最大的药物灾难”,4,美国、法国、捷克斯洛伐克等少数国家幸免此灾难.美国吸取了1938年磺胺醑剂事件的教训,没有批准进口“反应停”。当时的FDA(食品药品管理局,Food and Drug Administration)官员在审查该药时发现缺乏足够的临床试验数据而拒绝进口。从而避免了此次灾难。,5,2006年8月13日经济半小时播出了半小时观察:触目惊心的药品不良反应节目,吴广兴, 11岁,小学四年级学生 主诉发冷, 在某诊所接受治疗,镜头一:,6,第一组药: 50
2、毫升的地塞米松和30毫升的清开灵,然后把两种药一起装进输液瓶给小广兴输上了。 第二组药,林霉素钠,可就在小广兴静脉注射第二组药到一大半时,意外发生了。患儿出现全身抽搐,喷射状呕吐, 脸色发青,小便失禁,最后出现了休克,在这家诊所输液3个多小时后,小广兴被送上了120急救车,送到了佳木斯市中心医院,佳木斯中心医院给出的结果是,输液反应,呼吸系统衰竭,循环系统衰竭,中心医院进行了全力救治仍然没能挽回孩子的生命。 2004年7月4日,吴广兴永远离开了深深宠爱着他的家人。,7,镜头二:,在山东章丘农村的孩子中,有些孩子的屁股上都有一个深深的伤疤,而比伤疤更可怕的是他们不能像其他的同龄孩子一样去跑去跳,因为他们都患上了同一种病叫“臀肌挛缩症”。单腿无力抬高,双腿无法下蹲,走路一瘸一拐,他们被叫做青蛙腿。,这些孩子都曾经在村卫生所进行过青霉素的注射。,8,青霉素有两种制剂,一个叫钾盐一个叫钠盐,这个钾盐太疼了,刺激性很大,那个小孩打起来那个屁股疼极了,为了解决这个问题,医院就采取了一个办法。” 医院的办法就是用一种叫做苯甲醇的注射液来溶解青霉素,主要是为了缓解小孩打针的疼痛。,苯甲醇是一种局部麻醉
3、药,9,镜头三: 中药,一些含有关木通、马兜铃、青木香、成份的中药制剂,能够引起严重的肾脏损伤的不良反应; 清开灵注射液能够引起过敏性休克的不良反应; 壮骨关节丸能够引起严重肝损伤的不良反应; 葛根素注射剂能够引起急性血管内溶血的严重不良反应; 莲必治注射液能够引起严重急性肾损伤的不良反应。,10,美国1966年-1996年的39项前瞻性研究的Meta分析结果:住院患者中发生严重药物不良反应6.7% 致死性不良反应0.32% 其他研究资料显示: 1. 住院病人:10%-20%; 2. 住院病人因药物不良反应死亡:0.24%-2.9%; 3. 因药物不良反应而住院的病人:0.3%-5.0%。,药物不良反应的发生情况:,2014年全国药品不良反应监测网络收到药品不良反应/事件报告表132.8万份,较2013年增长了0.8%。其中新的和严重药品不良反应/事件报告34.1万份,占同期报告总数的25.7%。1999年至2014年,全国药品不良反应监测网络累计收到药品不良反应/事件报告表近790万份。,中 国,12,2004-2014 年新的和严重以及严重药品不良反应/事件报告比例,13,报告来源
4、:,图3 2014年药品不良反应/事件报告不同来源比例,图2 2014年药品不良反应/事件报告年龄分布,图4 2014年药品不良反应/事件报告涉及药品类别分布,涉及药品情况分析:,图5 2014年药品不良反应/事件报告涉及药品剂型分布,16,不良反应很多为什么?,17,原因(一)?,药物的安全是相对的,“是药三分毒” 药物有两面性,是一把“双刃剑”, benefit/risk,18,原因(二)?,批准上市的药品并非就是可以放心使用的药品 药政部门权衡利害关系,通常会批准更有效更安全的药物上市 有些引起不良反应较多或较严重不良的药物,如果有其特殊用途,在没有找到理想的替代品之前,也会被批准上市,19,原因(三)?,动物实验不足以预见药物应用于人类的安全性问题,20,原因(四)?,临床研究的局限性,1.新药的临床研究样本数有限,期 耐受性试验、药代动力学 24例 期 安全有效性评价 100对 期 开放扩大试验 300对 期 上市后药物监查 2000例,21,统计学认为:,如果某药物的某种不良反应发生率是1,从统计学的角度讲,需要在3000例中使用,才有95%的把握发现1例反应。,22,2.
《流行病学第17章药物流行病学》由会员xuz****an分享,可在线阅读,更多相关《流行病学第17章药物流行病学》请在金锄头文库上搜索。

有限理性学说在股票投资决策行为分析中的应用(ppt 24)

服装销售客人常问问题(DOC11页)

服装市场营销教案(DOC35页)

端午节服装促销方案(DOC9页)

服装销售中的问答(DOC22页)

品牌服装全年促销方案(DOC7页)

服装品牌拓展营销企划书(DOC9页)

证券投资分析培训教材(doc 25)

工商业贷款证券化概述(doc 20页)

某银行考试试题(doc29页)

内部控制的一般标准(doc_15)

理财之星-管账王简介

管理财务(PPT43页)

中建X局第三建设有限公司XXXX年内控培训

内部控制_控制活动

一元一次方程解应用题--利润问题54

3只要贡献利润大于或等于零

家庭理财基础知识(ppt 50页)

何时获得最大利润、最大面积是多少
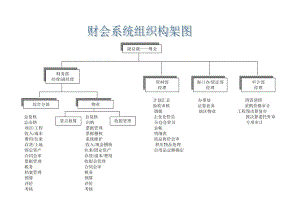
企业内部控制文件--组织机构及岗位职责(doc 19)
 应对行业变革挑战策略
应对行业变革挑战策略
2024-04-11 25页
 应对经济环境变化的策略布局(资料)
应对经济环境变化的策略布局(资料)
2024-04-11 37页
 并购重组项目总结与反思
并购重组项目总结与反思
2024-04-11 28页
 年度财务审计报告解读(资料)
年度财务审计报告解读(资料)
2024-04-11 31页
 年度品牌影响力报告(资料)
年度品牌影响力报告(资料)
2024-04-11 36页
 市场趋势分析与预测会议
市场趋势分析与预测会议
2024-04-11 29页
 市场调研报告及趋势预测(资料)
市场调研报告及趋势预测(资料)
2024-04-11 22页
 市场调研中的伦理与法律问题
市场调研中的伦理与法律问题
2024-04-11 27页
 市场营销趋势与消费者行为分析会议
市场营销趋势与消费者行为分析会议
2024-04-11 34页
 市场营销扩大商业影响力
市场营销扩大商业影响力
2024-04-11 32页

